相关推荐

靶向TROP2 ADC芦康沙妥珠单抗纳入突破性疗法认定
12月25日,国家药品监督管理局药品审评中心(CDE)显示:靶向TROP2 ADC芦康沙妥珠单抗(sac-TMT,亦称SKB264/MK-2870)(佳泰莱®)联合默沙东的抗PD-1单抗帕博利珠单抗(可瑞达®)一线治疗PD-L1 TPS≥1%的EGFR基因突变阴性和ALK阴性的局部晚期或转移性非小细胞肺癌(NSCLC)...
免疫管家 2026-01-06

2025年肿瘤治疗的重大进步,精准治疗再进一步,让患者生存更久、活得更好
2025年,肿瘤学领域取得了重要进展,美国食品药品监督管理局(FDA)批准了多款创新抗癌药物,覆盖乳腺癌、肺癌等不同癌种。这些药物的获批反映了肿瘤治疗向基于分子分型和个体需求的精准医疗时代全面迈进。以下将聚焦于2025年FDA批准的四大重磅新药叙述。
免疫管家 2026-01-05

第三代EGFR TKI甲磺酸伏美替尼片拟纳入突破性治疗
12月25日,国家药品监督管理局药品审评中心(CDE)显示:艾力斯医药自主研发的第三代EGFR TKI甲磺酸伏美替尼片(艾弗沙)被纳入拟突破性治疗品种公示名单,拟定适应症为:具有表皮生长因子受体(EGFR)PACC突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
免疫管家 2026-01-04

中位缓解33.7个月!溶瘤病毒在胰腺癌、肝癌、脑瘤、肺癌、前列腺癌等领域频传捷报,数据亮眼
12月29日,Theriva™ Biologics宣布其核心临床候选药物VCN-01联合吉西他滨/白蛋白紫杉醇标准疗法(SoC)化疗,用于一线治疗转移性胰腺导管腺癌(PDAC)的三期临床试验设计方案获得欧洲药品管理局(EMA)人用药品委员会(CHMP)提供的科学建议。
免疫管家 2025-12-31

美国TIL疗法售价370万,中国自主研发TIL疗法无需高强度化疗,显著降低治疗风险,哪些癌症患者可能受益?
2024年2月16日,美国食品药品监督管理局(FDA)批准了首款TIL细胞疗法AMTAGVI™(lifileucel)上市,用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。这一突破为癌症患者带来了更多希望和另一次机会。
免疫管家 2025-12-30

埃万妥单抗注射液(皮下注射)获得国家药监局批准,用于治疗EGFR突变的晚期非小细胞肺癌患者
12月25日,强生公司宣布其旗下创新治疗药物锐珂捷®——埃万妥单抗注射液(皮下注射)正式获得国家药品监督管理局批准,用于治疗携带表皮生长因子受体(EGFR)突变的晚期非小细胞肺癌(NSCLC)患者。
免疫管家 2025-12-26

国内外TIL疗法捷报频传!TIL疗法在肺癌、宫颈癌等多类实体瘤中显现曙光,癌症患者未来可期!
近日,美国食品药品监督管理局(FDA)批准沙砾生物自主研发的新一代基因敲除型肿瘤浸润淋巴细胞(TIL)产品GT307注射液的临床试验申请。
免疫管家 2025-12-26

新选择!TCR-T细胞疗法已见显著疗效,肉瘤、黑色素瘤、宫颈癌、胰腺癌患者迎来新希望
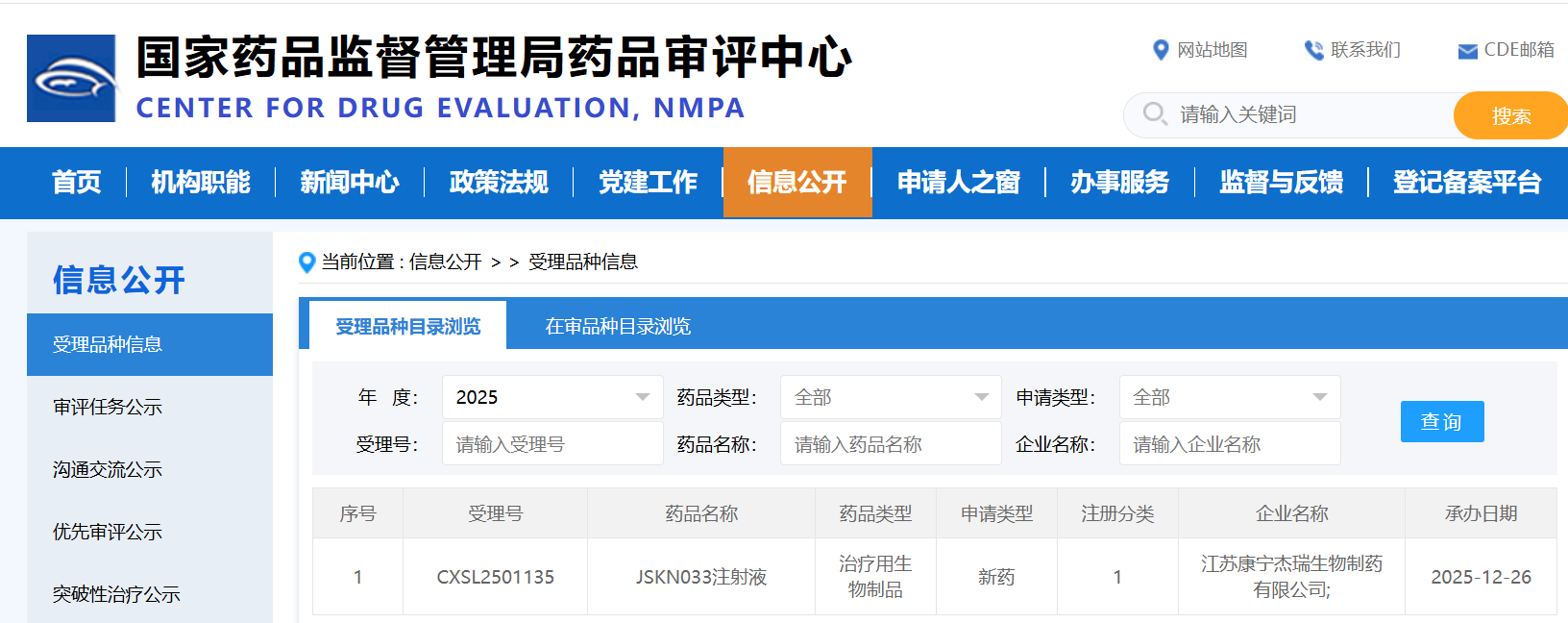
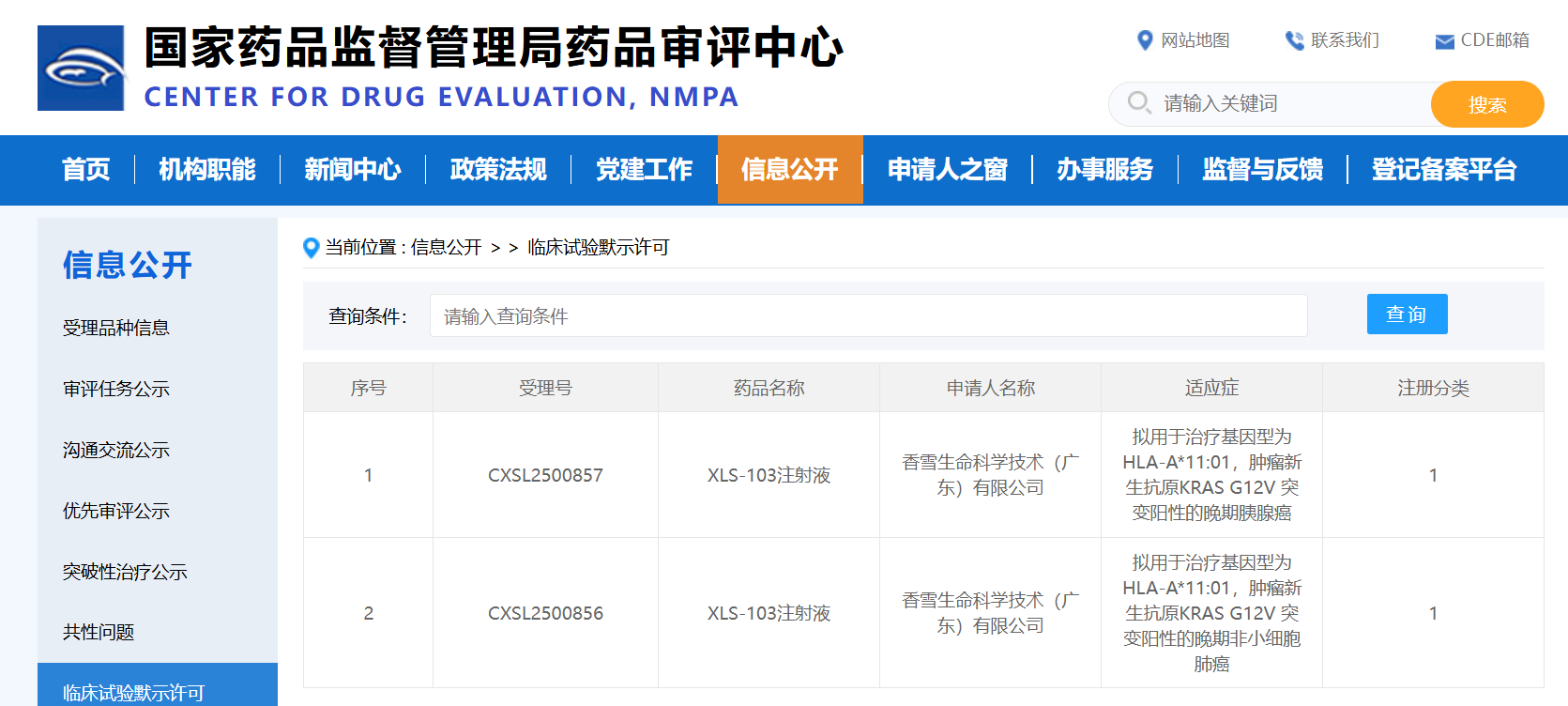
12月22日,国家药品监督管理局药品审评中心(CDE)显示:香雪生命科学自主研发的高亲和力TCR-T细胞治疗产品XLS-103注射液新药临床试验申请(IND)获得批准,用于治疗基因型为HLA-A*11:01,肿瘤新生抗原KRAS G12V突变阳性的晚期非小细胞肺癌以及晚期胰腺癌。
免疫管家 2025-12-25
TCR-T细胞治疗产品“XLS-103注射液”新药临床试验申请获批
12月22日,香雪生命科学宣布其自主研发的高亲和力TCR-T细胞治疗产品“XLS-103注射液”新药临床试验申请(IND)获得国家药品监督管理局药品评审中心(CDE)批准,用于治疗基因型为HLA-A*11:01,肿瘤新生抗原KRAS G12V突变阳性的晚期非小细胞肺癌以及基因型为HLA-A*11:01,肿瘤新生抗原KR...
免疫管家 2025-12-24

5年生存率突破90%!《柳叶刀》重磅研究:质子治疗为头颈癌患者带来生存与生活质量双重获益
12月11日,美国MD安德森癌症中心研究人员在《柳叶刀》发表了质子治疗在口咽癌中的三期临床试验结果。该试验表明,接受质子治疗治疗的口咽癌患者相较于传统放疗具有显著的生存益处。
免疫管家 2025-12-23