相关推荐

APG-2575(lisaftoclax)和APG-115(alrizomadlin)的临床研究最新进展即将亮相2025年ASCO
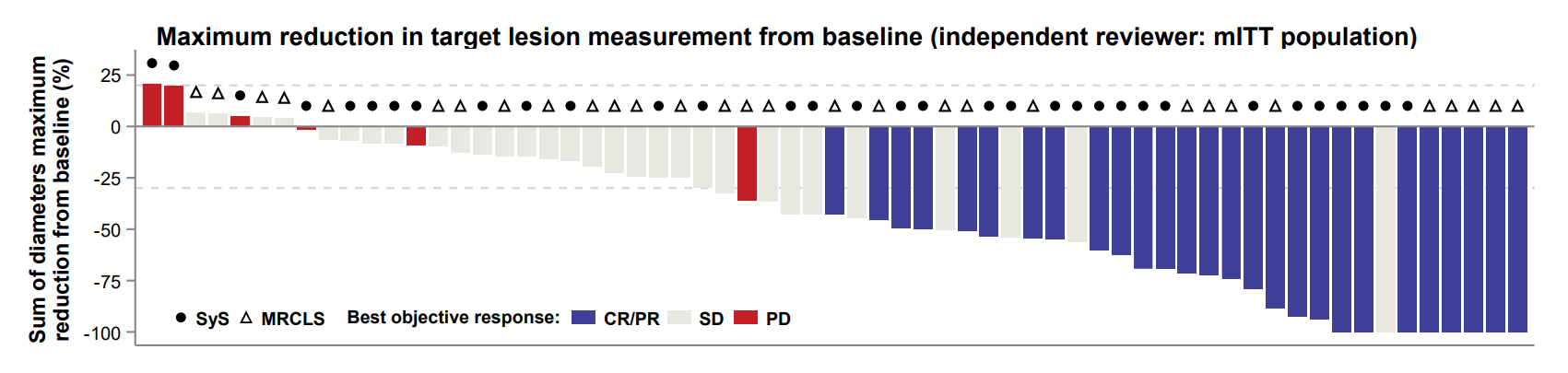
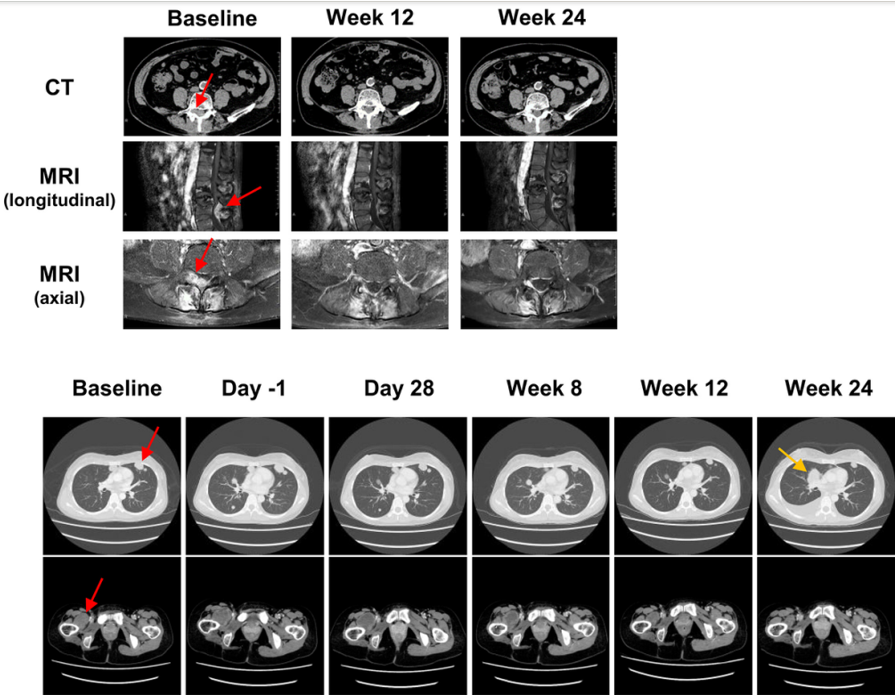
近日,亚盛医药宣布,将在2025年美国临床肿瘤学会(ASCO)年会上报告APG-2575(lisaftoclax)治疗多种血液系统肿瘤和APG-115(alrizomadlin)治疗实体瘤的临床研究最新进展。这两项临床研究的最新数据表明lisaftoclax和alrizomadlin均具有潜在的抗肿瘤活性。
免疫管家 2025-05-26

“新宠”来袭!TCR-T细胞疗法启动,靶向范围超CAR-T,晚期肝癌、结直肠癌患者福音
近日,国家卫生健康委员会批准首都医科大学附属北京地坛医院体细胞临床研究机构与临床研究项目的备案。在此背景下,“KRAS特异性自体TCR-T细胞注射液临床研究”项目启动会成功召开,将为有特异性基因突变的晚期肝癌和结直肠癌患者带来新的治疗希望。
免疫管家 2025-02-28