热门推荐
- 精 疾病控制率高达90%!TCR-T细胞横扫黑色素瘤、宫颈癌、肉瘤、肝癌等实体瘤,肿瘤缩小81%!
- 精 首款用于治疗实体瘤的TCR-T细胞疗法获批在即!非小细胞肺癌治疗43天肿瘤缩小
- 精 肿瘤新型杀伤武器-TCR-T细胞疗法在肝细胞癌、胰腺癌、卵巢癌、尿路上皮癌等癌种中前景广阔
- 精 87%患者肿瘤缩小!TCR-T疗法惠及滑膜肉瘤、黑色素瘤等实体瘤!
- 精 87% 患者肿瘤缩小!TCR-T疗法IMA203用以治疗经治转移性黑色素瘤患者的最新数据公布
- 精 治疗8个月约25个肺部肿瘤完全消退!TCR-T治疗在宫颈癌等多种HPV相关肿瘤中表现优异
- 精 TCR-T狙击手已到位,狙击宫颈癌,肝癌等多款实体瘤!
- 精 肝癌晚期怎么办?TCR-T和CAR-T细胞疗法迎来新希望
- 精 与CAR-T媲美的细胞疗法,看“显眼包”TCR-T如何攻击癌细胞?
- 精 攻克实体瘤哪家强,细胞疗法找TCRT
- 精 TCR-T细胞疗法针对实体瘤患者的临床试验开始了
- 精 国内TCR-T细胞疗法获批临床
资讯列表
7月22日,国家药监局药品审评中心(CDE)官网显示,TCR-T细胞产品TAEST16001注射液拟纳入突破性治疗品种,拟用于治疗组织基因型为HLA-A*02:01,肿瘤抗原NY-ESO-1表达为阳性的软组织肉瘤。
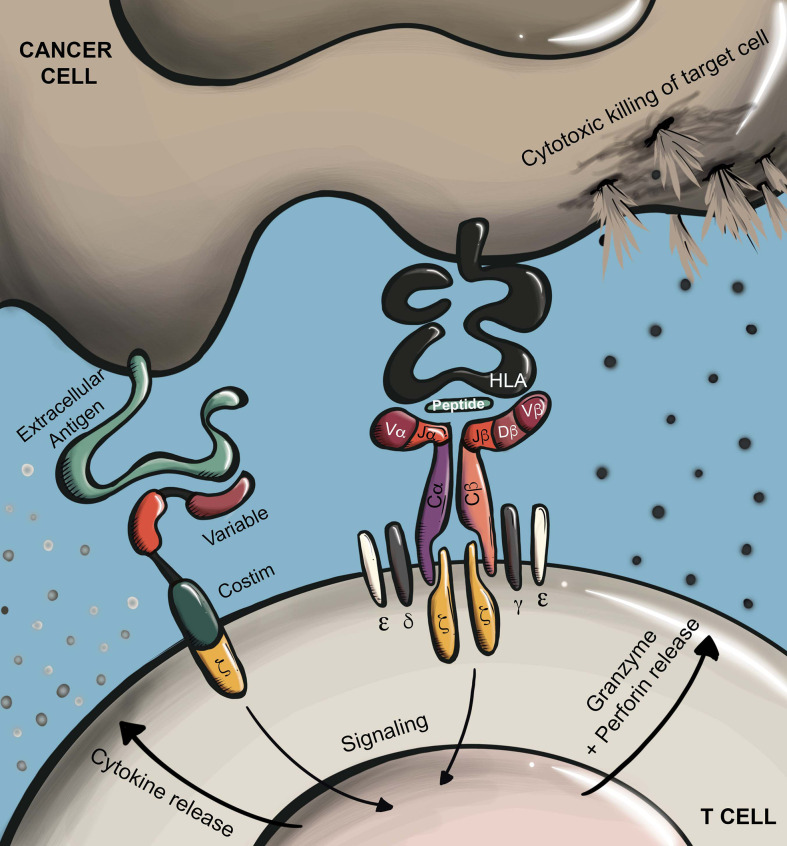
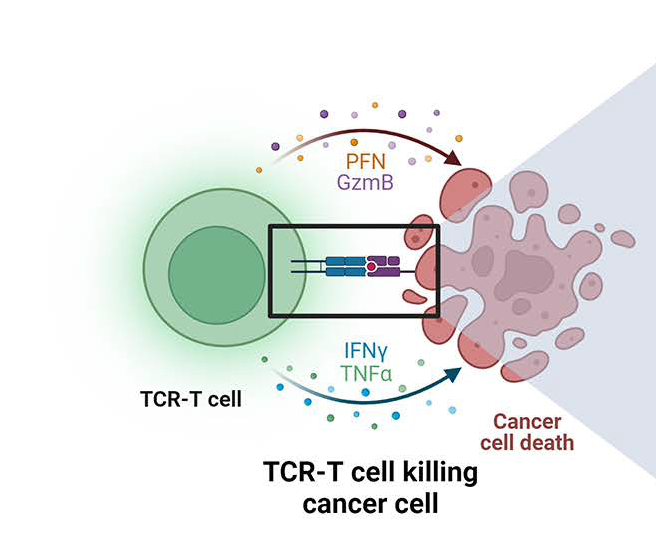
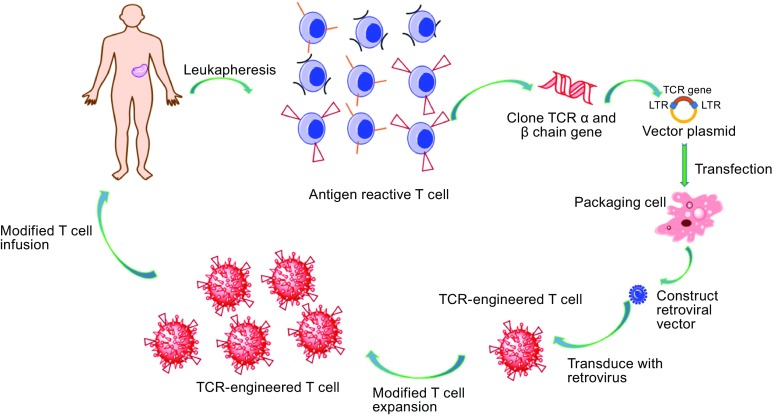
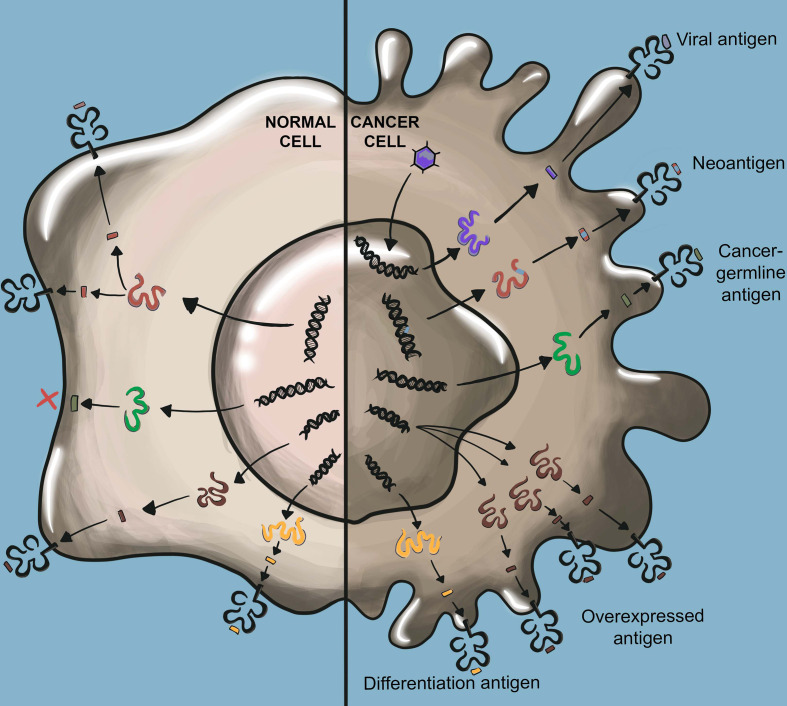
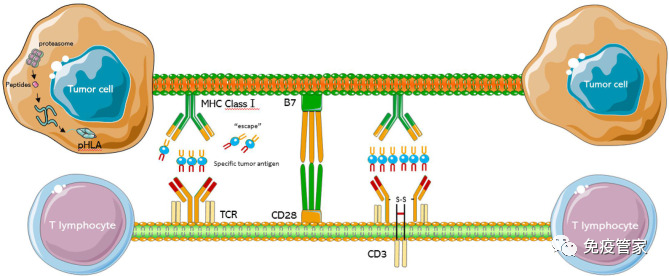
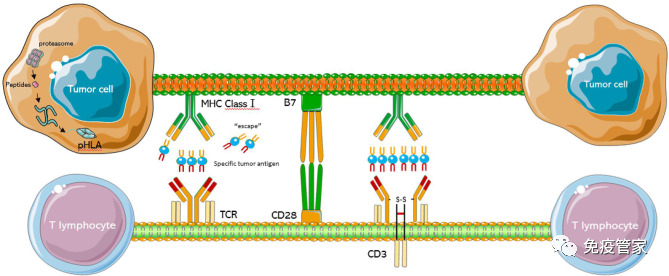
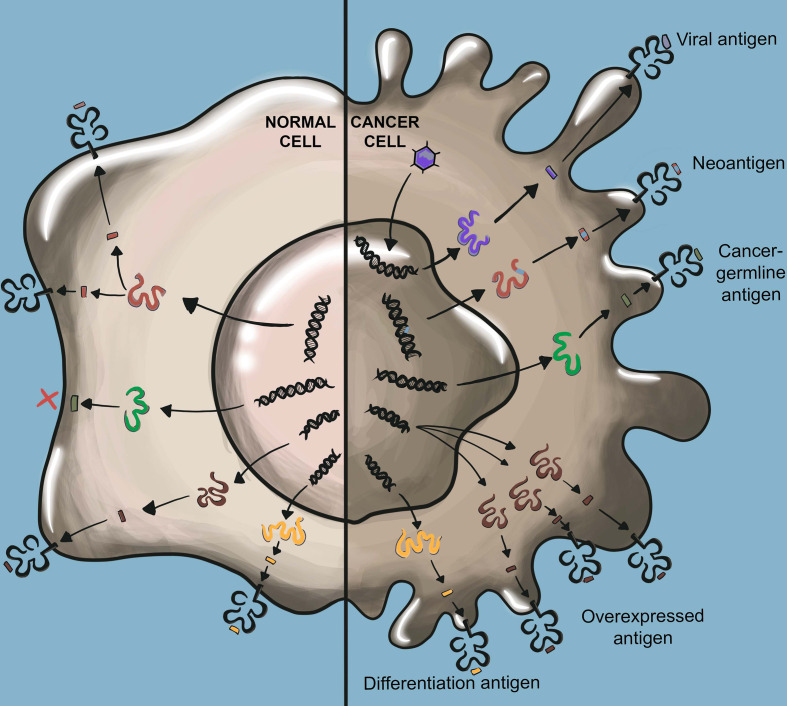
T细胞是适应性免疫的重要组成部分,TCR是T细胞功能的守门人,通过检测靶细胞的蛋白质组来识别肿瘤细胞或病原体的重要系统。经过数年的研究,TCR-T细胞疗法作为一个新的、有前途的治疗方法在实体瘤的领域取得了重大成功。
宫颈癌是女性常见的妇科肿瘤之一。相关疾病报告显示,2020年在中国15-44岁女性中,宫颈癌发病率和死亡率均居女性肿瘤第三位,新发病例数约将近11万,死亡病例将近6万。
岁月如梭,时光荏苒,不知不觉中2024年已经过去了一半。上半年首款TIL疗法Amtagvi(lifileucel)获批为黑色素瘤患者带来了细胞免疫疗法的治疗选择。而即将到来的八月份,也有首款用于治疗晚期滑膜肉瘤的TCR-T细胞疗法有望获批。
血液系统肿瘤患者的“救星”CAR-T细胞疗法是近年来科研人员的研究热点,一直活跃在患者的眼前,让人们看见了生的希望。但是CAR-T细胞疗法并没有想象中的那么完美!到目前为止,国内外上市的十几款的CAR-T产品没有任何一款是针对实体瘤的。为此,TCR-T细胞疗法登上了实体肿瘤治疗的大舞台。
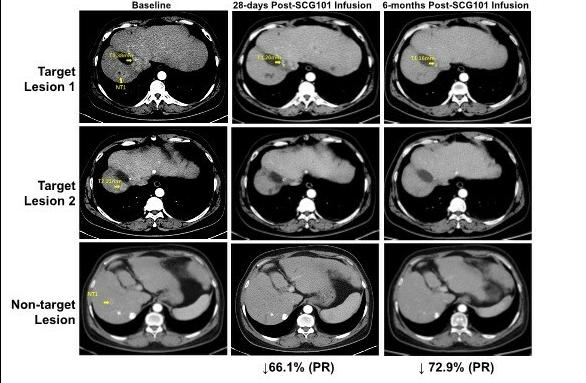
6月7日,在2024年欧洲肝脏研究协会年会(EASL Congress 2024)上乙型肝炎病毒(HBV)特异性TCR-T细胞疗法SCG101凭借突破性临床数据,获得专家组的高度认可。
2024年5月25日,“第十七届全国肝脏疾病临床学术大会”在沈阳顺利开幕。此次大会上,侯金林教授表示TCR-T细胞具有较强的免疫记忆功能,可以在体内存活较长时间,发挥持续抗肿瘤效应。并介绍了美国Eric Tran团队通过TCR-T细胞疗法治疗胰腺癌的成功案例。
5月14日,Immatics公司在其2024年第一季度的财务报告上公布其在研T细胞受体T细胞(TCR-T)疗法IMA203用以治疗经治转移性黑色素瘤患者的最新数据。分析显示,87%的患者实现肿瘤缩小,患者的确认客观缓解率(cORR)达55%。Immatics计划在2024年下半年的医学会议上,提供IMA203的下一次临...