热门推荐
- 精 缓解超2年!CAR-T疗法横扫多发性骨髓瘤、B细胞淋巴瘤,缓解率实现惊人的100%!
- 精 实至名归!CAR-T先驱获2024年沃伦·阿尔珀特奖!CAR-T细胞疗法重击淋巴细胞白血病!
- 精 靶向GPC3的CAR-T疗法联合药物获得了完全缓解和长期生存,肝细胞癌患者的福音
- 精 CAR-T细胞产品-CT071获批,血液系统肿瘤患者又增新的治疗选择
- 精 GRP78 CAR-T的研究让肿瘤治疗更上一层楼
- 精 CAR-T产品-纳基奥仑赛价格跌破百万,肿瘤患者的福音
- 精 PD-1免疫抑制剂与CAR-T细胞疗法让肿瘤无处躲藏
- 精 CAR-T细胞疗法在骨髓瘤,白血病以及淋巴瘤中大展身手!
- 精 CAR-T在多种实体瘤和血液瘤中全面开花!
- 精 与时间赛跑,CAR-T疗法让淋巴瘤患者重获新生!
- 精 攻克癌症有方法——CAR-T,TILS各显神通
- 精 白血病并不是不治之症CAR-T细胞疗法在血液肿瘤大放光彩
- 精 “抗癌神药”CAR-T疗法到底是班门弄斧还是真有奇效?免疫管家与你揭开谜底。
- 精 解密CAR-T疗法真实治疗流程,细胞治疗到底需要多久呢?
- 精 CAR-T疗法再传捷报!卵巢癌,结肠癌再创佳绩!攻克实体瘤火力全开!!
- 精 120万一支,天价抗癌药,到底值不值?
资讯列表
7月20日,国家药品监督管理局(NMPA)正式受理重庆精准生物自主研发的国家一类生物新药pCAR-19B细胞自体回输制剂(普基仑赛注射液)上市申请(NDA),该产品是国内首款针对儿童白血病的CAR-T产品,用于治疗3-21岁患有CD19阳性复发/难治性急性淋巴细胞白血病(ALL)的患者。
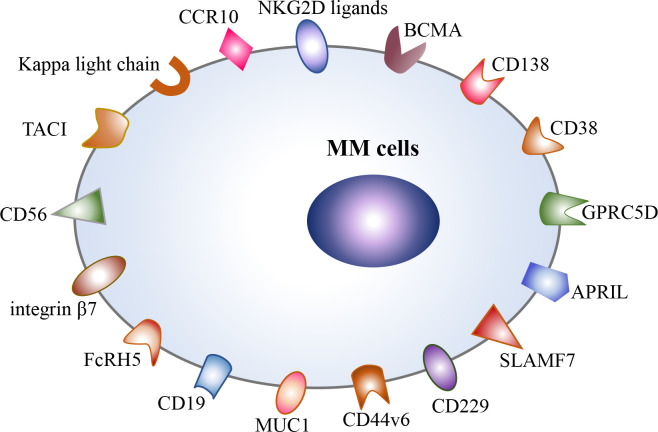
7月24日,驯鹿生物宣布其自主研发的全人源靶向BCMA嵌合抗原受体自体T细胞注射液(伊基奥仑赛注射液)拟用于治疗多发性硬化症(Multiple Sclerosis, MS)的新药临床试验申请(IND)已获得美国食品药品监督管理局(FDA)的默示许可。
7月24日,驯鹿生物宣布其自主研发的全人源靶向BCMA嵌合抗原受体自体T细胞注射液(伊基奥仑赛注射液)的新药临床试验申请(IND)已获得美国食品药品监督管理局(FDA)的默示许可,拟用于治疗多发性硬化症(Multiple Sclerosis, MS)。这是伊基奥仑赛注射液在2024年继难治性全身型重症肌无力(gMG)之...
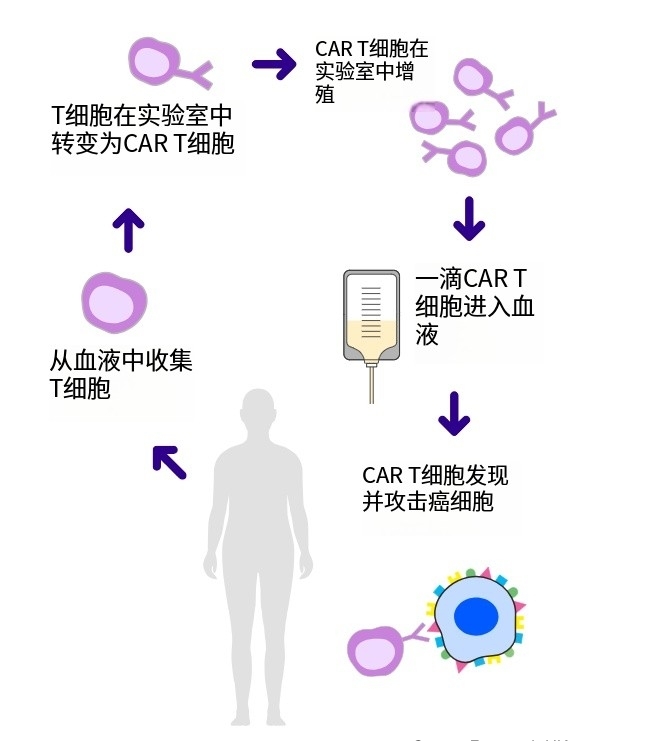
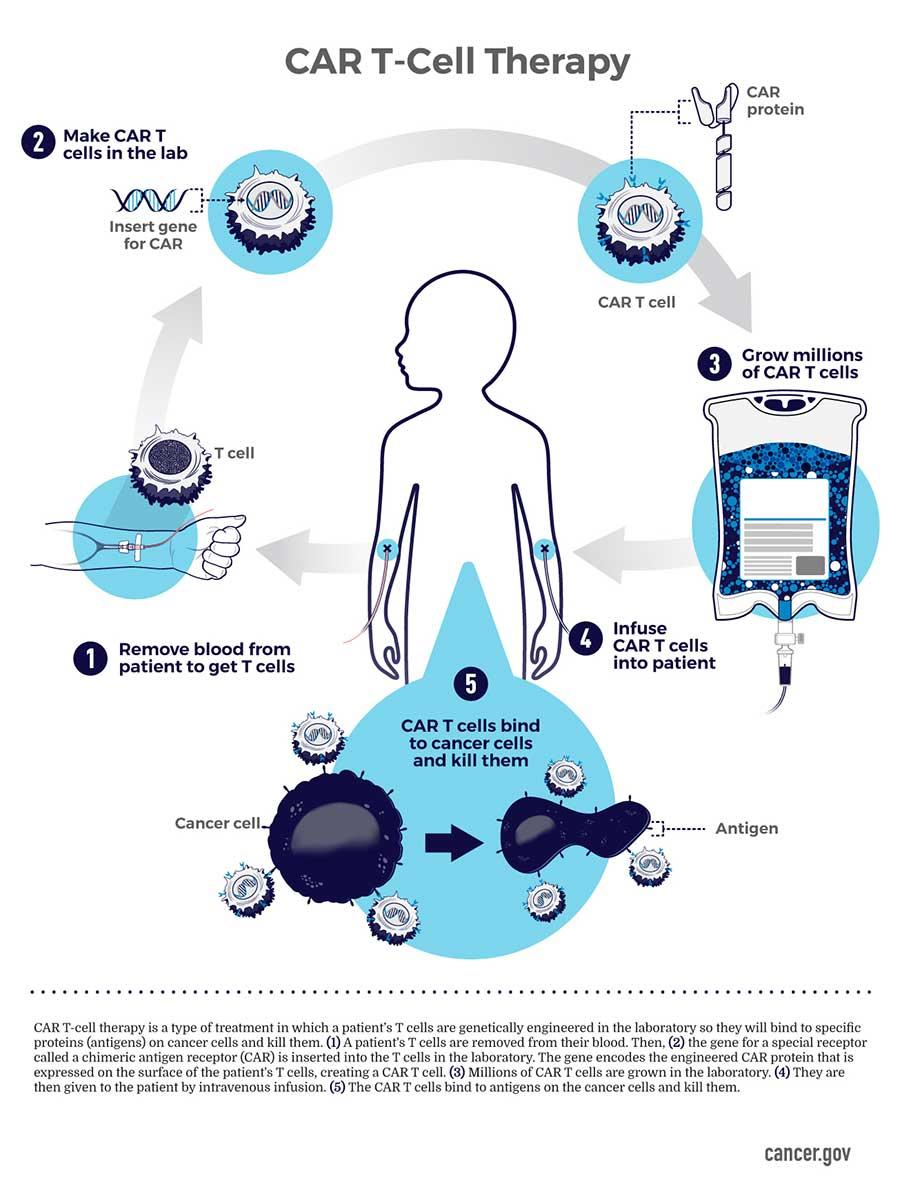
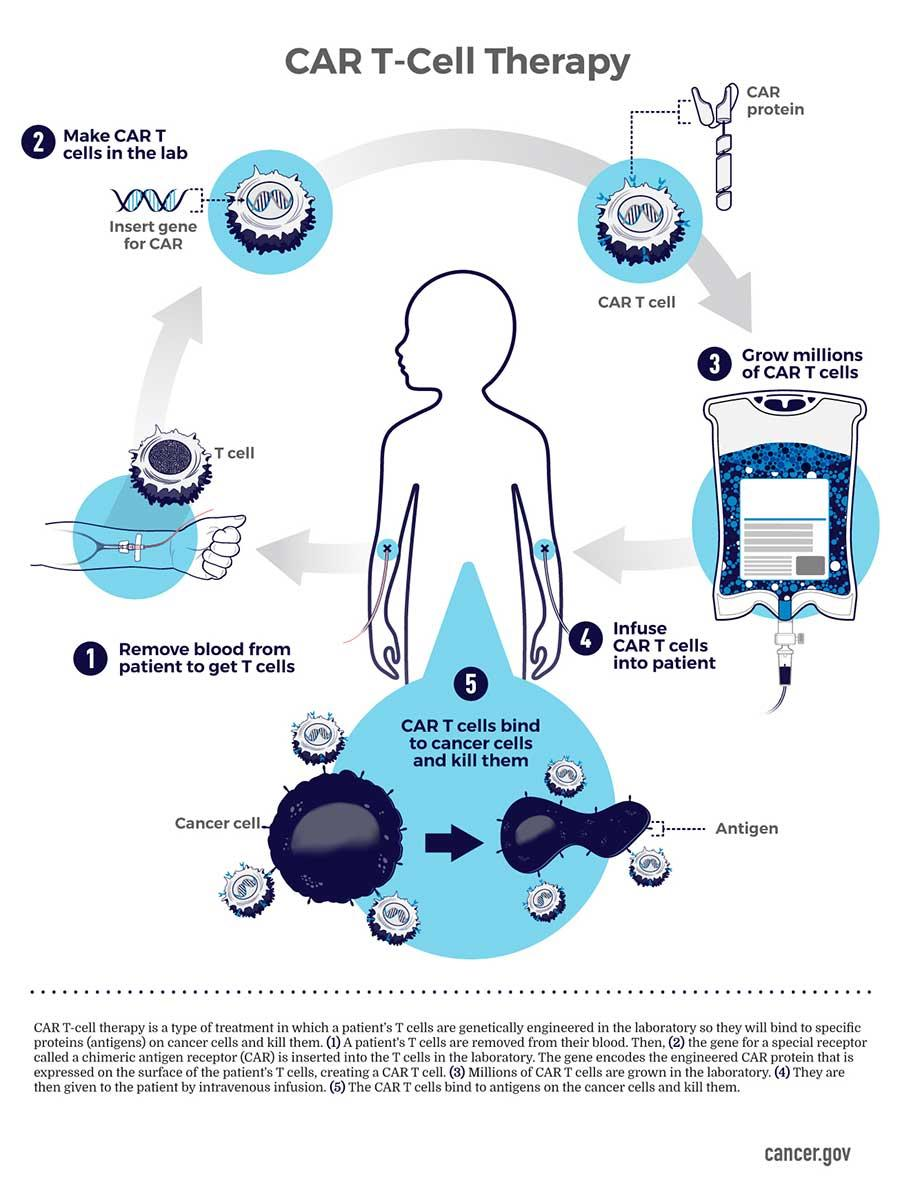
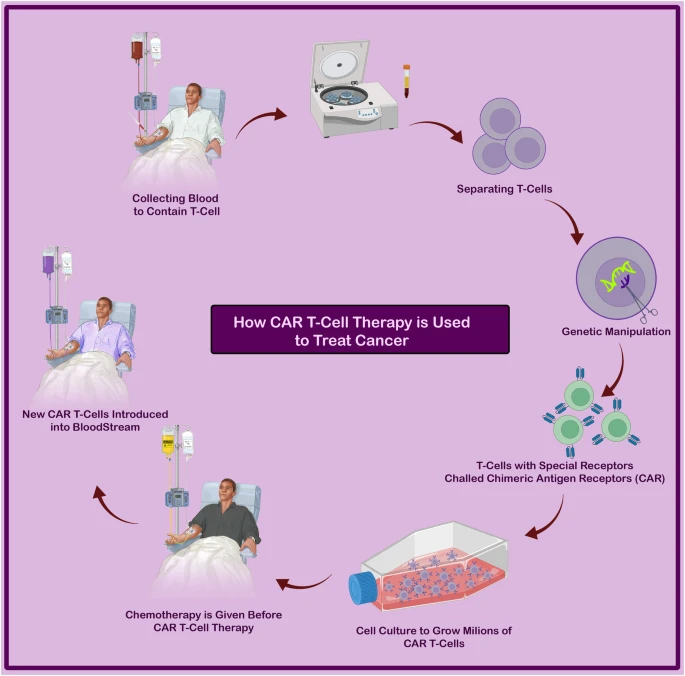
通过将患者自身免疫系统的T细胞提取后升级,再将升级后的T细胞重新输注回体内,由这些T细胞来消灭癌细胞的治疗方式就是现在“爆火”的CAR-T疗法。
UTAA06注射液是一款基于I型γδT细胞开发的通用现货型B7-H3-CAR-Vδ1T细胞产品,其CAR结构携带了可显著增强Vδ1T细胞抗肿瘤持久性的关键元件,使其具有丰富的抗肿瘤途径、强大的肿瘤浸润能力、优越的抗肿瘤持久性等优势,具备了克服实体肿瘤的潜能。适应症为晚期恶性实体肿瘤,主要针对肿瘤细胞膜表面B7-H3表达...
PA3-17注射液是全球首款获批IND的自体CD7-CAR-T产品,2021年11月和2022年12月,PA3-17注射液分别被美国食品药品监督管理局(FDA)和欧盟委员会(EC)授予了孤儿药资格认定。2021年8月获得CDE批准进入注册临床试验,用于治疗难治/复发T淋巴母细胞白血病/淋巴瘤。
7月15日,海军军医大学第二附属医院(上海长征医院)研究团队在国际顶尖学术期刊《Cell》上发表了一篇题为“Allogeneic CD19-targeted CAR-T therapy in patients with severe myositis and systemic sclerosis”的研究论文,文章介绍了...
7月15日,原启生物宣布其靶向GPRC5D的嵌合抗原受体 (CAR) T细胞疗法(OriCAR-017)已获得美国食品药品监督管理局(FDA)授予快速通道资格用于治疗复发/难治性多发性骨髓瘤(RRMM)。