胃癌(GC),是发生在胃部的癌症,最初癌细胞是来源于胃的黏膜上皮细胞,最常见的病理类型是腺癌。早期胃癌术后的5年生存率可达90.9%-100%,然而晚期胃癌仍然缺乏有效的治疗手段,即使积极采取综合治疗,其5年生存率仍然不足30%。
大部分早期胃癌患者无症状,少数患者可有饱胀不适、消化不良等轻微不适,不容易引起重视。进展期胃癌可出现上腹痛、体重下降等不适,晚期患者还会出现贫血、厌食、消瘦等症状病程的终末期,患者会表现为严重消瘦,如皮包骨头一样,称之为恶性质状态或恶病质。
大部分胃癌患者,就诊最常见的原因是上腹痛和体重下降,但是此时胃癌很可能已经处于中晚期。早期胃癌患者常无症状,部分患者仅仅表现为原发病(癌前病变)的症状如饱胀不适、消化不良等,就很容易被忽视。若出现体重减轻、上腹痛、厌食、黑便、上腹部触及肿块等症状,更应尽快就医。
治疗
1、外科手术仍然是目前治疗胃癌的主要方法,也是治疗胃癌的主要手段。早期患者术后可获得根治。但由于发现胃癌较晚,大多数属于晚期肿瘤,手术疗效欠佳而进展期患者需要根据胃癌病理学类型及临床分期,采用以手术治疗为主,联合围手术期化疗、放疗、生物靶向治疗等手段的综合治疗,以达到延长患者生存期限,改善患者的生存质量。
2、对术前估计肿瘤不能根治性切除者,可考虑行术前化疗(包括动脉插管介入化疗),抑制肿瘤进展,使手术切除成为可能,术中发现有或可能有肝转移、腹膜转移者,可在肿瘤供应血管或腹腔内给予化疗,术后针对手术残留的肉眼看不见的肿瘤细胞进行化疗,预防肿瘤复发。
3、作为胃癌非手术疗法的内镜下治疗有很大进展。方法有胃镜下黏膜切除术和旨在破坏局部癌组织的激光、微波治疗及酒精注射等。一般用于早期胃癌或高龄、重症病人不能耐受外科手术者。
4. 大部分晚期患者当中应用免疫治疗,免疫治疗就是通过激活患者自身的免疫细胞,以此来控制身上肿瘤细胞的生长、发展以及扩散的治疗方式。大部分是应用于胃癌的晚期患者当中。免疫治疗与手术、化疗并用,有改善患者免疫功能,延长生存期的作用。
PD-1(程序性死亡受体1),是一种重要的免疫抑制分子,为免疫球蛋白超家族,是一个288氨基酸残基的膜蛋白。以PD-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。
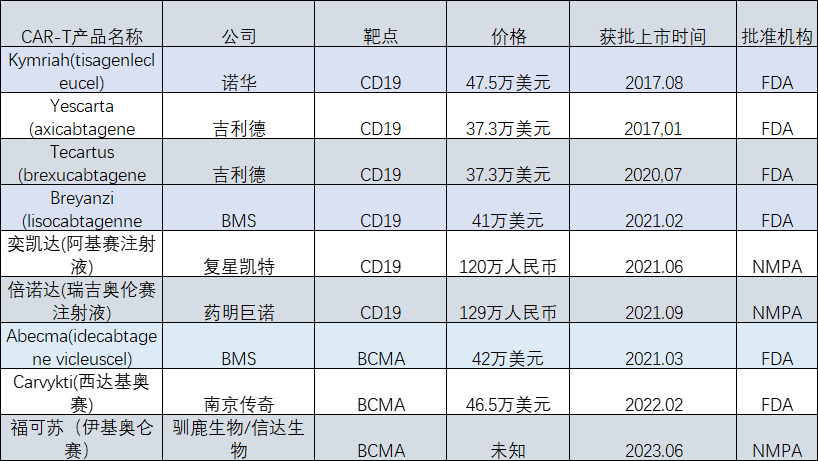
CAR-T疗法就是嵌合抗原受体T细胞免疫疗法。这是一种治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得很好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。
CLDN18是肺和胃上皮细胞紧密连接的一个主要成分,有两个异构体,分别是Claudin18.1(CLDN18.1)和Claudin18.2(CLDN18.2)。CLDN18.2只在胃粘膜上分化的上皮细胞中表达,正常情况下是不表达于其他任何健康组织。然而,它在原发性恶性肿瘤中高度表达,如胃癌、乳腺癌、结肠癌和肝癌。CLDN18.2由261个氨基酸组成,有四个跨膜结构域(Figure 2)和两个胞外环(胞外环:ECL1,ECL2),其NH2和COOH端均位于细胞内。CLDN18.1和CLDN18.2仅在ECL1大约50个氨基酸的序列中有7个氨基酸残基差异。CLDN18.2通常埋藏在胃粘膜中,正常组织中的单克隆抗体基本上接触不到,恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的CLDN18.2表位暴露出来,成为特定的靶点。因此,CLDN18.2赋予靶向治疗的特异性。我国研究人员开发了国际上首个靶向ClDN18.2的CAR-T细胞产品CTO41。
CT041是一种潜在全球同类首创的靶向CLDN18.2蛋白的自体CAR-T细胞候选产品,用于治疗CLDN18.2阳性实体瘤,主要治疗胃癌、食管胃结合部腺癌及胰腺癌。
2022年6月6日,科济药业公布了两篇关于CTO41的研究结果,其包含了: 在美国进行的针对晚期胃癌和胰腺癌患者的多中心Ib期试验的结果以及在中国进行的针对晚期胃癌、食管胃结合部腺癌 (GC/GEJ) 患者的lbII期试验的安全性和初步疗效结果。
1.lb期试验( NCTO4404595)
在lb期试验中,纳入了CLDN18.2阳性患者,包括之前接受过至少两种前线系统治疗的胃癌、食管胃结合部腺癌患者以及至少接受过一种前线治疗的胰腺癌患者
此项临床试验数据显示,与历史治疗方案相比,CT041在既往接受多线治疗的胃癌患者中可能有显著的抗肿瘤活性改善。
2.lb/II期试验(NCTO4581473)
Ib/II期试验是指在评估中国胃癌、食管胃结合部腺癌患者的安全性和有效性。
b期研究关键入选标准: 符合参与本研究资格的人群为至少二线治疗失败或不耐受的CLDN18.2表达阳性的晚期胃癌、食管胃结合部腺癌患者HER2阳性患者应接受过标准抗HER-2治疗。
初步研究结果表明,CT041在接受晚期胃癌/食管胃结合部腺癌患者中具有显著疗效及可控的安全性。
CT041是目前全球唯一进入到确证性II期临床试验的用于治疗实体瘤的CAR-T细胞候选产品。现在正在招募患者,想要参加的可直接咨询管家(400-880-3716)
药物名称:CT041自体CAR T细胞注射液
入选标准
1 | 自愿参加临床试验;本人完全了解、知情本研究并签署知情同意书;愿意遵循并能完成所有试验程序 |
2 | 年龄在18-75岁,男女均可 |
3 | 经病理确诊的晚期胃/食管胃结合部腺癌患者,且接受至少二线治疗失败;或经病理确诊的晚期胰腺癌患者,且至少一线治疗失败 |
4 | 受试者肿瘤组织样本免疫组织化学(IHC)染色为CLDN18.2呈阳性 |
5 | 预计生存期 >12周 |
6 | 按照RECIST1.1标准要求存在可测量肿瘤病灶 |
7 | 筛选期、单采前24小时内 ECOG体力状态评分0~1 |
8 | 具备单个核细胞采集(简称单采)足够的静脉通路 |
9 | 受试者在筛选和预处理前(基线时)应满足一定器官功能条件 |
10 | 育龄期女性受试者必须在筛选时和接受预处理前进行血清妊娠试验且结果为阴性,并愿意在使用末次研究治疗后1年内采用非常有效可靠的方法避孕。 |
11 | 与有生育潜能的女性有活跃性生活的男性,如果没有做输精管结扎术,必须同意使用阻隔法节育。 |
咨询电话:400-880-3716












