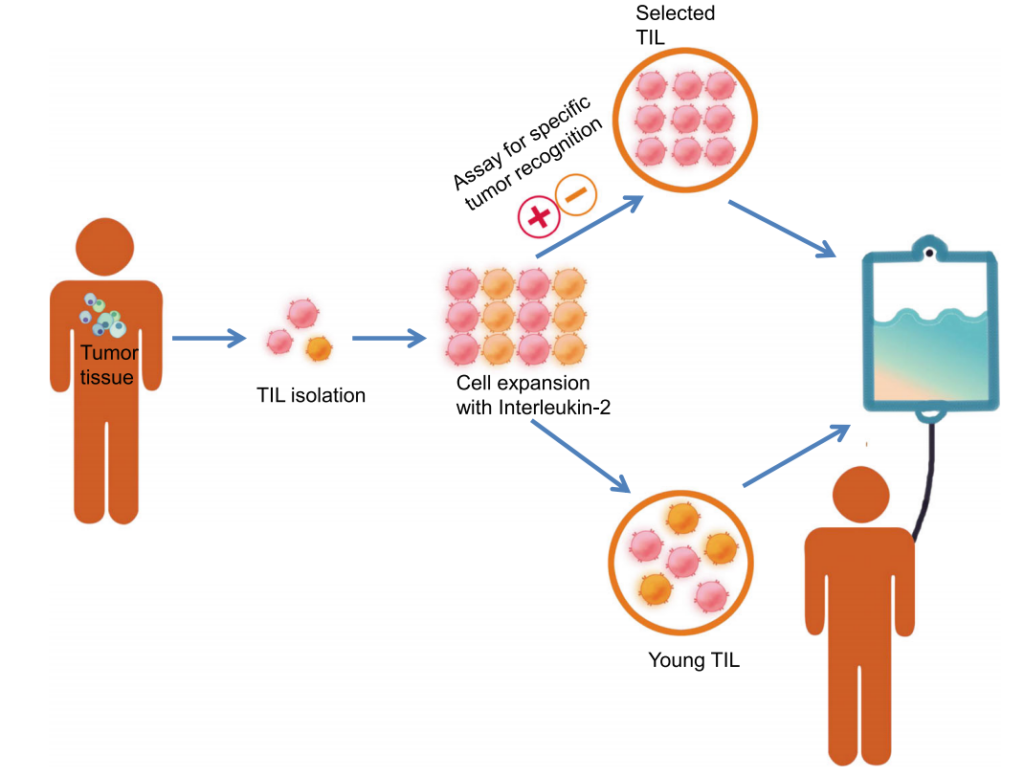
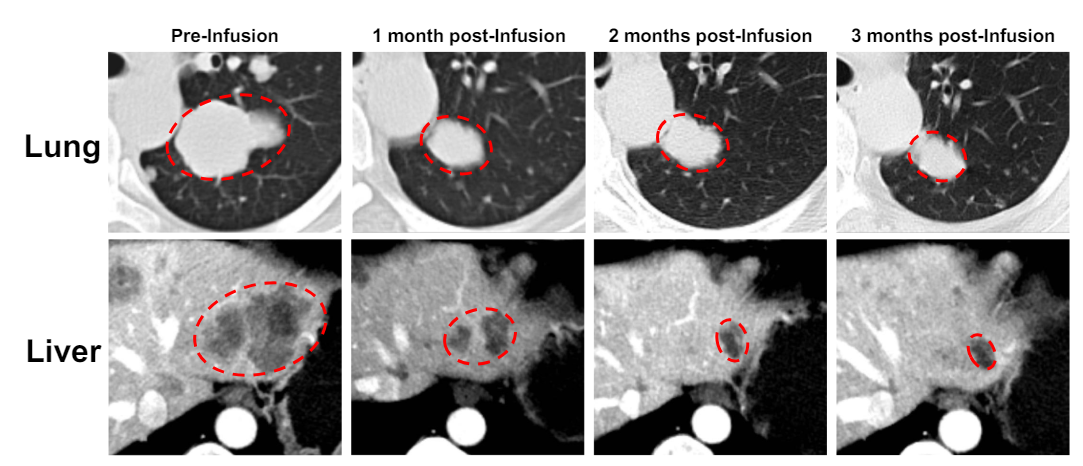
热门推荐
- 精 无癌生存超十年!TIL细胞疗法重击黑色素瘤、头颈鳞癌、宫颈癌!
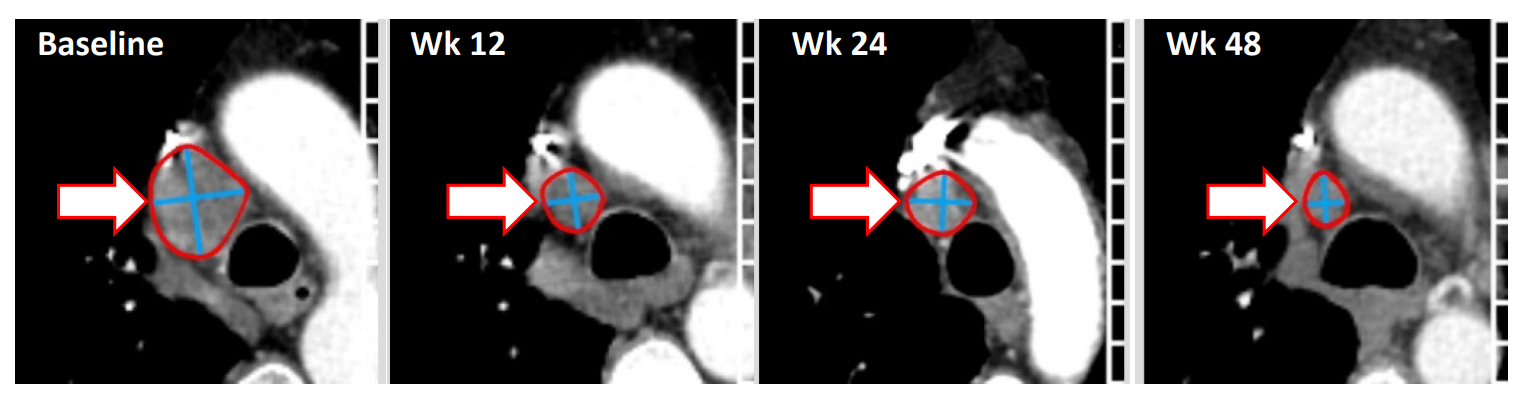
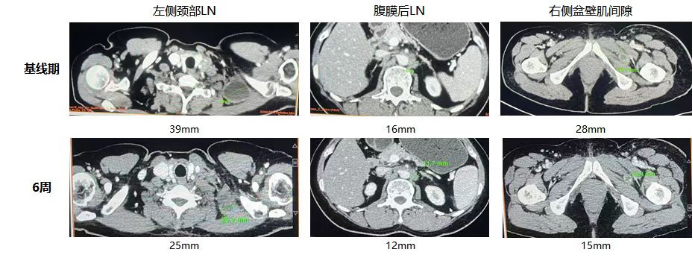
- 精 重磅亮相!我国TIL疗法GT101狙击宫颈癌,疾病控制率超90%!12周肿瘤缩小33%!
- 精 “火爆”癌友圈的TIL细胞疗法登上《解放日报》!临床缓解持续至今!
- 精 五个月肿瘤缩小60%!TIL细胞疗法GC203治疗卵巢癌最新数据公布!疾病控制率达83.3%!
- 精 无瘤状态超五年!中国成功研发全球首款无需清淋TIL疗法-GC101
- 精 免疫疗法未来之星:TILS细胞疗法表现出色,对战黑色素瘤、宫颈癌等多种实体瘤
- 精 TILS细胞疗法战斗力太强了吧!在黑色素瘤,宫颈癌等多种实体瘤中全面开花!
- 精 惊了!!!仅仅40天3个转移病灶完全消失!TIL(肿瘤浸润淋巴细胞)奋勇杀“癌”
资讯列表
2月5日,Iovance Biotherapeutics公布一项真实世界临床回顾性研究数据。该数据显示,在接受过治疗的晚期(不可切除或转移性)黑色素瘤患者中,商业化产品Amtagvi(lifileucel)展现出同类最佳的疗效特征,应答率创历史新高。这项真实世界研究结果在美国犹他州盐湖城举行的2026年美国移植与细胞治...
近日,在2026年美国移植与细胞治疗协会(ASTCT)暨国际血液与骨髓移植研究中心(CIBMTR)联合会议上公布的一项真实世界研究,为肿瘤浸润淋巴细胞疗法带来了令人鼓舞的消息,为TIL疗法的卓越潜力提供了强有力的新证据。
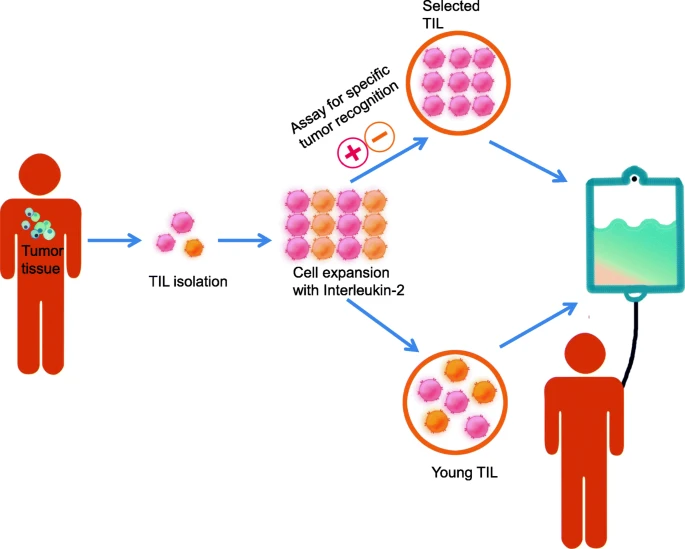
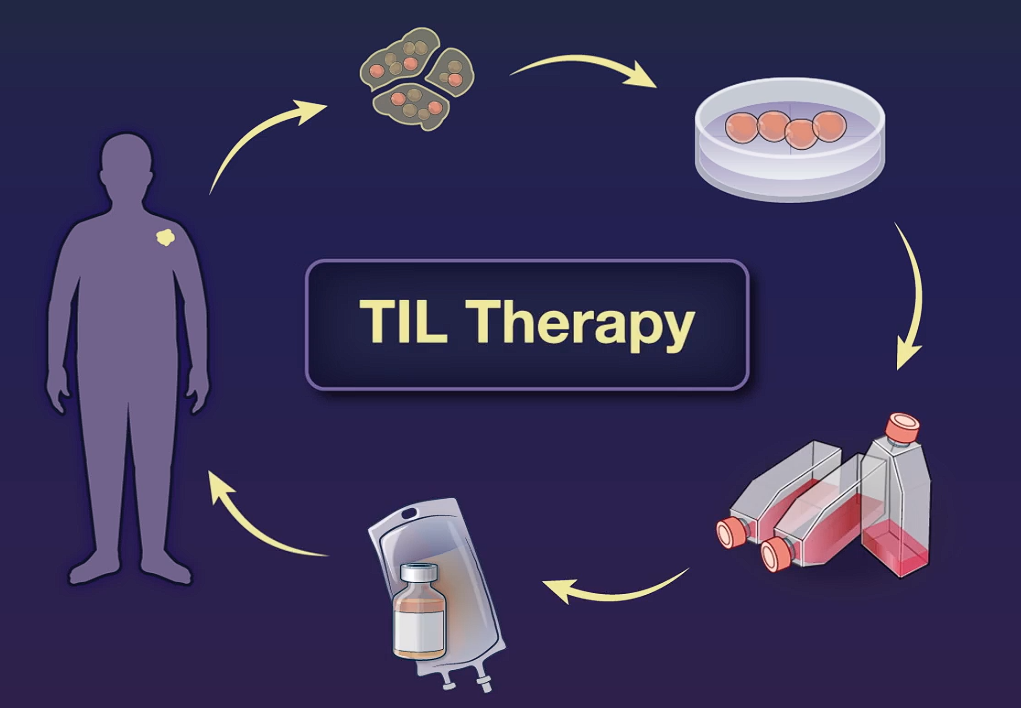
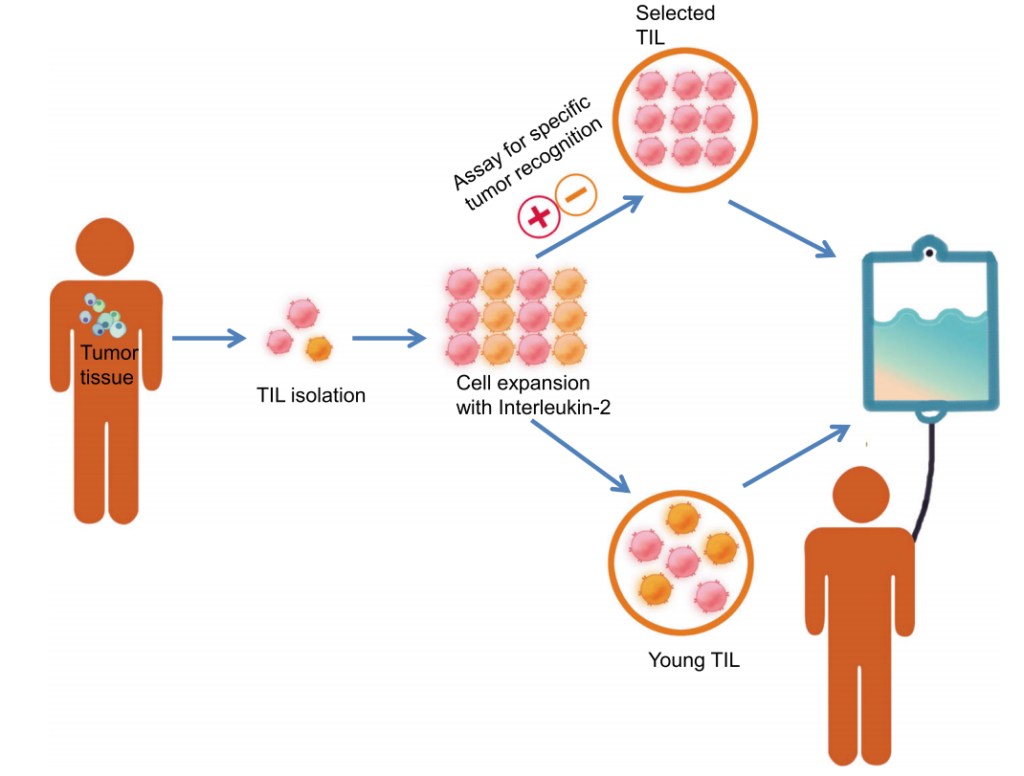
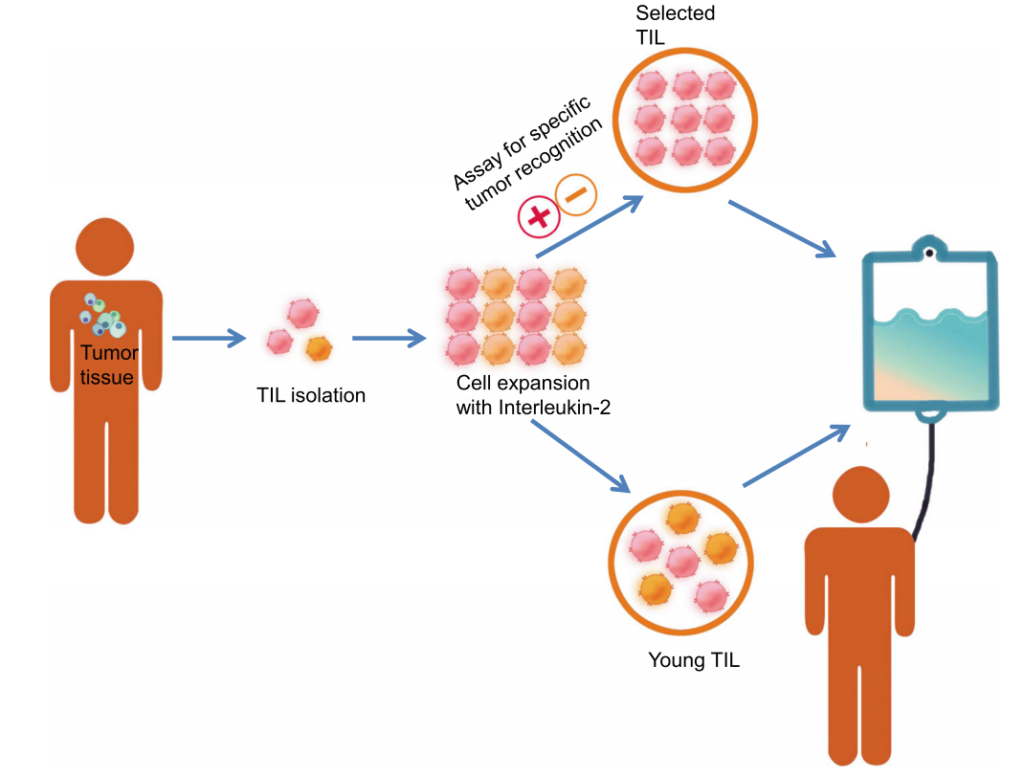
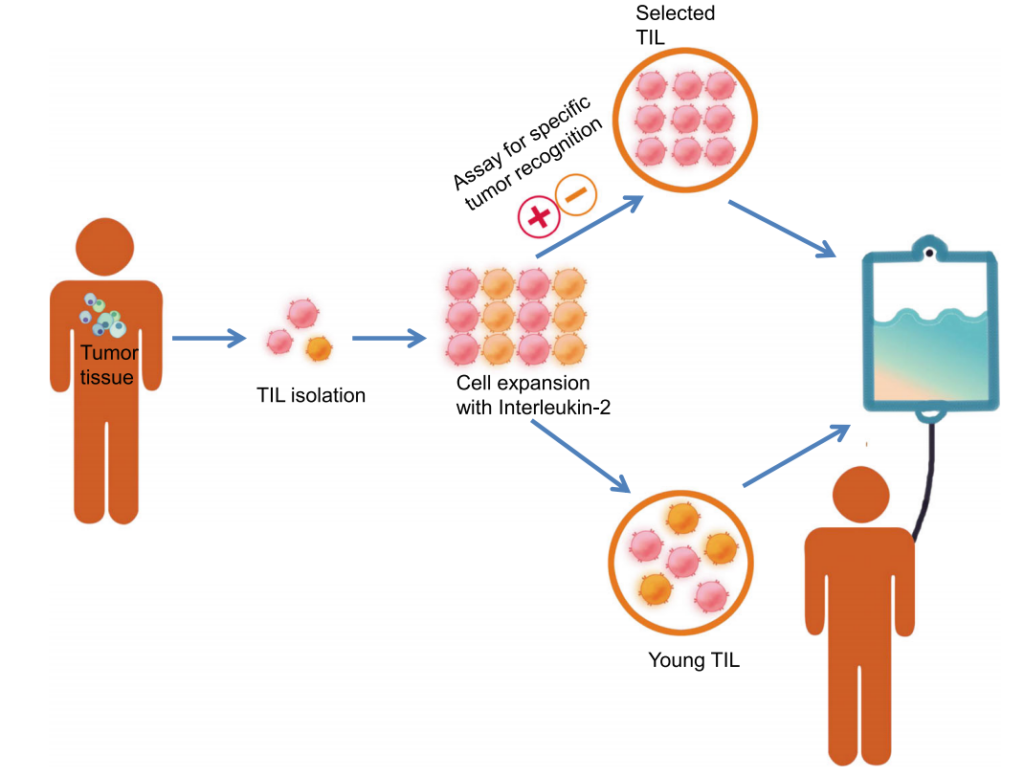
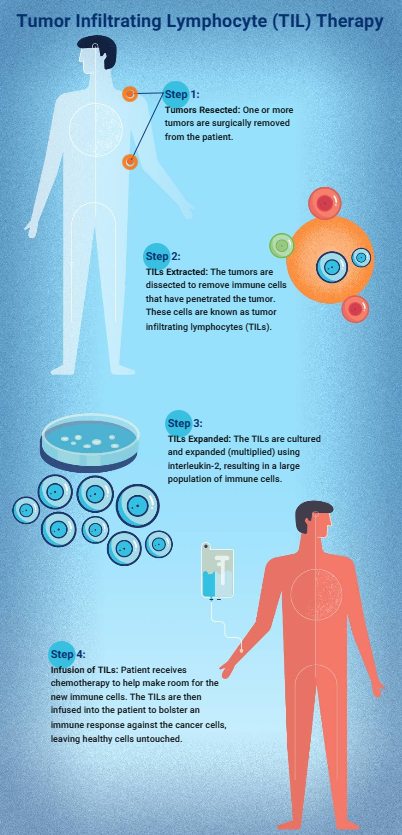
2024年2月16日,美国食品药品监督管理局(FDA)批准了一款名为肿瘤浸润淋巴细胞疗法(TIL疗法)用于治疗既往接受过免疫疗法或靶向治疗的不可切除或转移性黑色素瘤成年患者。这款TIL细胞疗法是首个获批用于实体瘤的细胞疗法。
对于许多晚期实体瘤患者来说,在看到CAR-T细胞疗法有效缓解血液系统肿瘤患者的病情时,需要新疗法的心变得更加迫切。2024年,首款用于实体肿瘤的TIL疗法终于获美国食品药品监督管理局(FDA)批准上市,成为近年来最具潜力的实体瘤治疗技术之一。
2024年2月,美国食品药品监督管理局(FDA)批准了首款TIL产品AMTAGVI(Lifileucel)用于治疗晚期黑色素瘤,标志着实体瘤细胞治疗新时代的开启。更令人振奋的是,中国企业在TIL领域持续深耕创新,已在全球竞争中崭露头角。
多年来,手术、放疗和化疗是癌症治疗的常见治疗方法。然而对于晚期实体瘤患者,当这些传统手段失效后,往往陷入无药可用的困境。2024年,美国食品药品监督管理局(FDA)批准了一种新型治疗方式-肿瘤浸润淋巴细胞(TIL)疗法用于治疗晚期黑色素瘤,这标志着全球首款用于实体肿瘤的T细胞疗法正式问世。
2024年2月16日,美国食品药品监督管理局(FDA)批准了首款TIL细胞疗法AMTAGVI™(lifileucel)上市,用于PD-1/PD-L1治疗后进展的晚期黑色素瘤。这一突破为癌症患者带来了更多希望和另一次机会。
近日,美国食品药品监督管理局(FDA)批准沙砾生物自主研发的新一代基因敲除型肿瘤浸润淋巴细胞(TIL)产品GT307注射液的临床试验申请。