相关推荐

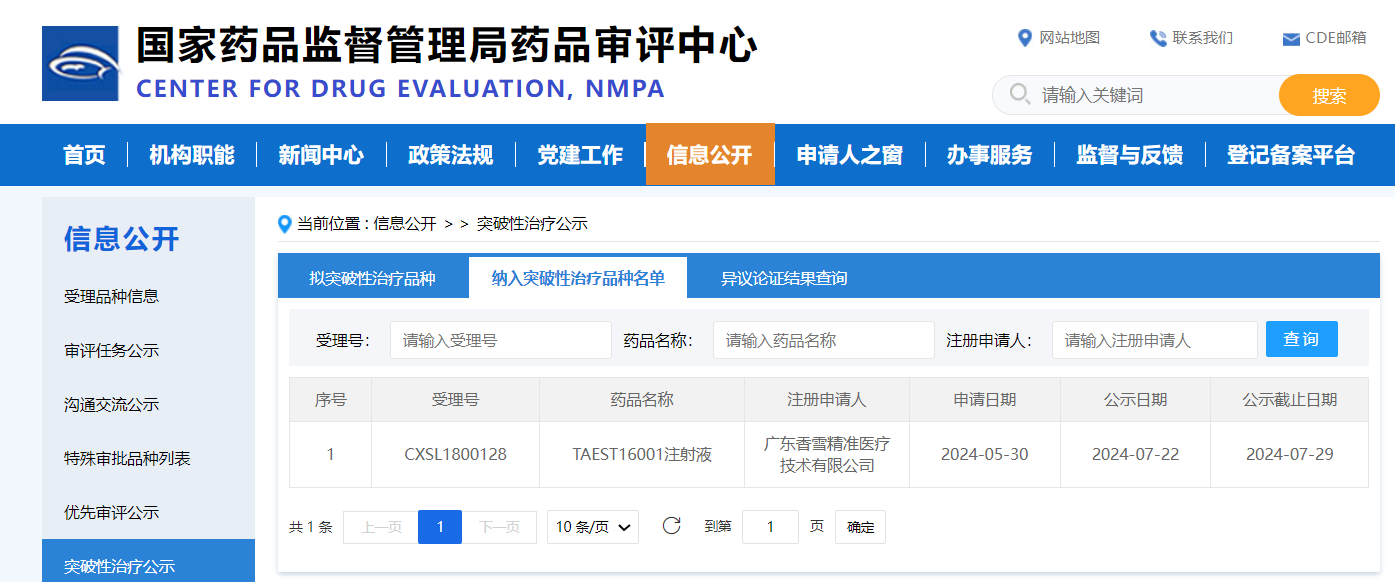
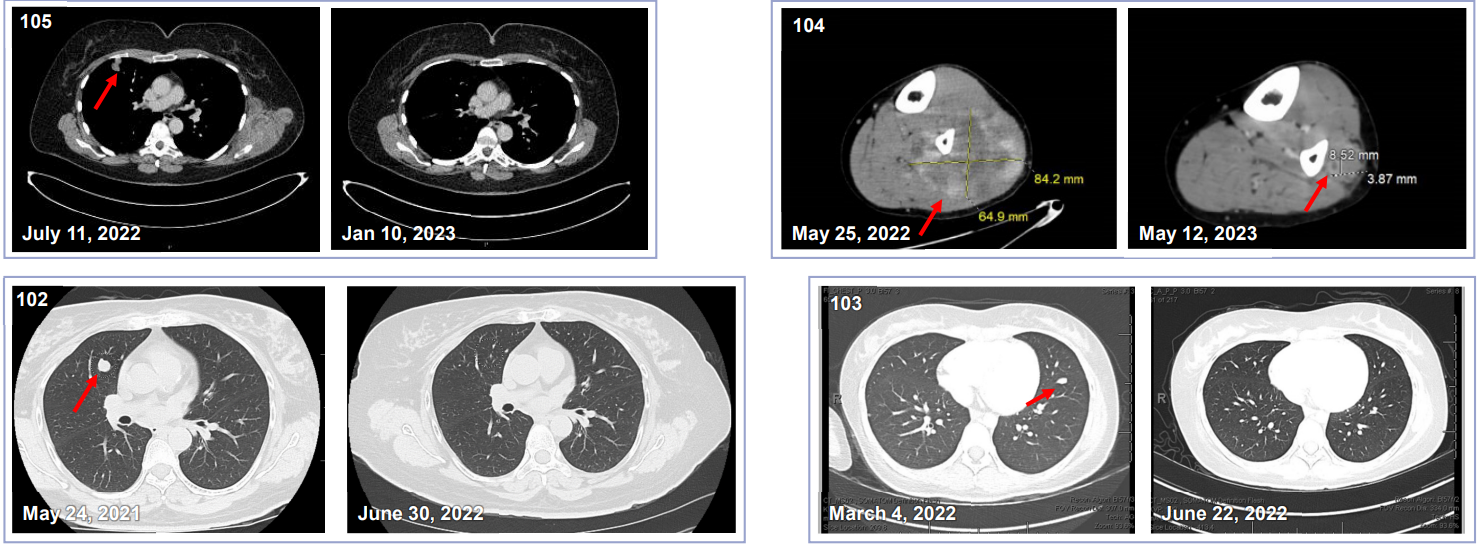
TCR-T疗法全球数据井喷,胃癌、肉瘤、肺癌、间皮瘤、黑色素瘤、肝癌将迎转机
近年来,随着生物技术的飞速发展,细胞免疫治疗给癌症治疗带来了新的希望。在这些进展中,TCR-T细胞疗法作为一种新的精准抗癌方法脱颖而出,逐渐成为肿瘤学领域的研究热点。到2025年,TCR-T疗法的多个全球临床试验报告了各种难治性癌症的数据,包括肝癌、胃癌、间皮瘤、卵巢癌、黑色素瘤、非小细胞肺癌(非小细胞肺癌)和脂肪肉瘤...
免疫管家 2025-05-28

美国FDA认证!一款造福于实体肿瘤的TCR-T细胞疗法有望为癌症患者减负担!
T细胞受体工程化T细胞疗法(TCR-T)是一种新型疗法,它通过使用患者自身的免疫细胞来对抗癌症。对于某些类型的癌症(如软组织肉瘤)患者来说,TCR-T细胞疗法是一种很有前途的疗法。
免疫管家 2025-05-21

TCR-T细胞疗法崭露头角,精准狙击肉瘤、黑色素瘤、结直肠癌
随着CAR-T细胞疗法的“爆火”,NK、TIL、TCR-T等免疫细胞疗法也逐渐引得注意。其中TCR-T细胞疗法通过利用基因编辑技术改造患者外周血的T细胞,这种改造后的T细胞回输患者体内后能够发挥特异性识别和杀伤肿瘤细胞作用。在临床试验中已经展现出卓越的疗效,为实体肿瘤患者带来了希望。
免疫管家 2025-04-25

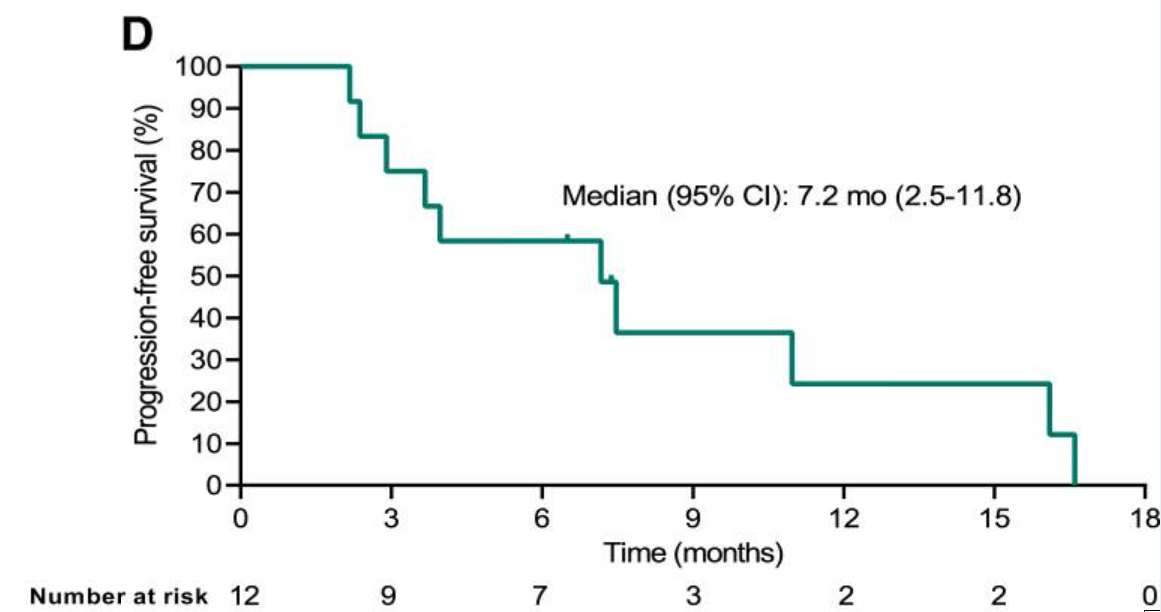
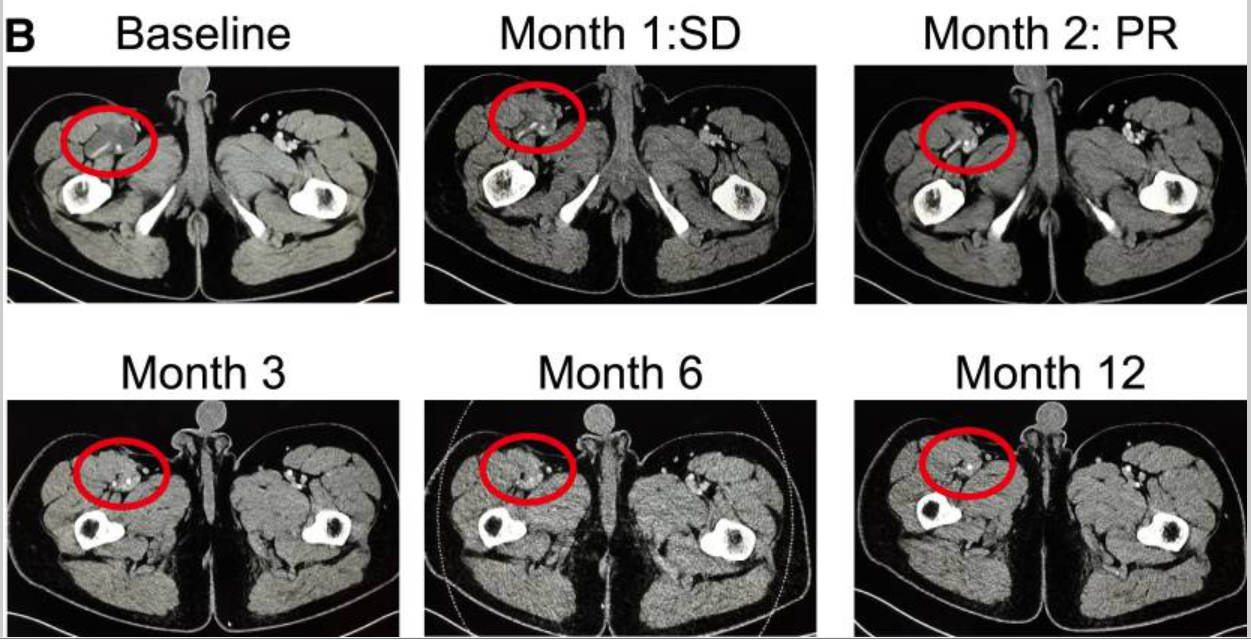
1个月病情稳定,2个月部分缓解!TCR-T疗法“暴击”肉瘤、肺癌、胰腺癌
不知不觉中,免疫疗法已经占据了癌症治疗版图的“半壁江山”。从免疫检查点抑制剂到CAR-T细胞疗法,人类对抗癌症的武器正在不断进步。随着CAR-T细胞疗法在血液肿瘤领域“高歌猛进”时,科学家们将目光投向了更具挑战性的实体肿瘤战场。
免疫管家 2025-04-02

“新宠”来袭!TCR-T细胞疗法启动,靶向范围超CAR-T,晚期肝癌、结直肠癌患者福音
近日,国家卫生健康委员会批准首都医科大学附属北京地坛医院体细胞临床研究机构与临床研究项目的备案。在此背景下,“KRAS特异性自体TCR-T细胞注射液临床研究”项目启动会成功召开,将为有特异性基因突变的晚期肝癌和结直肠癌患者带来新的治疗希望。
免疫管家 2025-02-28

TCR-T细胞产品lete-cel治疗肉瘤的研究数据登上《Journal of Clinical Oncology》
2025年1月21日,《Journal of Clinical Oncology》发表了TCR-T细胞产品letetresgene autoleucel (lete-cel)治疗晚期/转移性粘液样/圆细胞脂肪肉瘤的研究数据。
免疫管家 2025-02-18
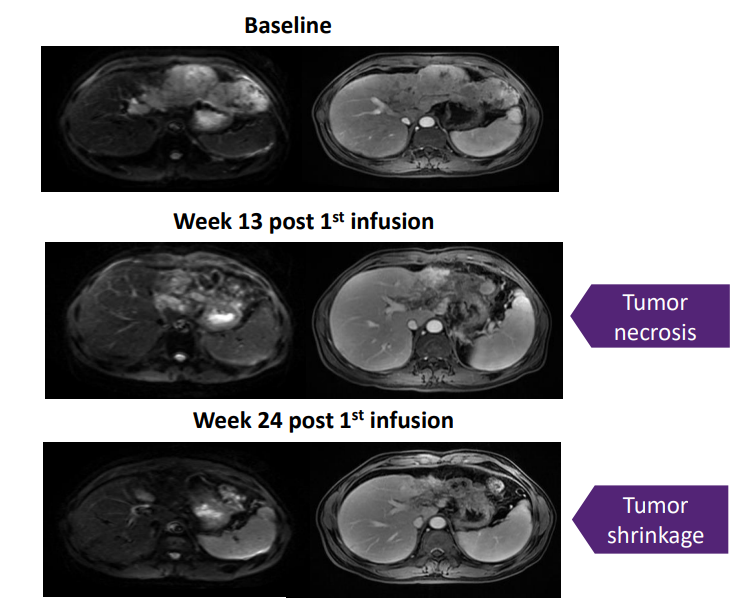
来恩生物TCR-T细胞产品Liocyx-M004获得美国FDA批准启动2期临床试验
近日,来恩生物宣布其mRNA编码TCR-T细胞疗法产品Liocyx-M004获得美国食品药品监督管理局(FDA)批准,启动国际多中心2期临床试验。
免疫管家 2025-02-12
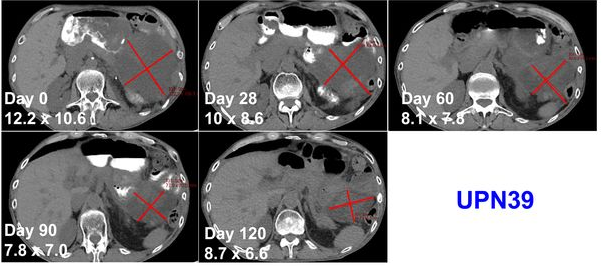
1年生存率高达90%!这两款TCR-T细胞疗法上市有望!肉瘤患者曙光
过继细胞疗法是癌症免疫疗法最有前途的领域之一,改造患者自身的 T 细胞以增强身体的天然抗肿瘤免疫反应,以对抗恶性肿瘤。但是如早期CAR-T研究所示,细胞因子释放综合征(CRS)的风险增加。为了提高过继性 T 细胞疗法的安全性和有效性,已经引入了使用 T 细胞受体(TCR)代替 CAR-T 来降低 CRS 风险的方法。
免疫管家 2025-01-14

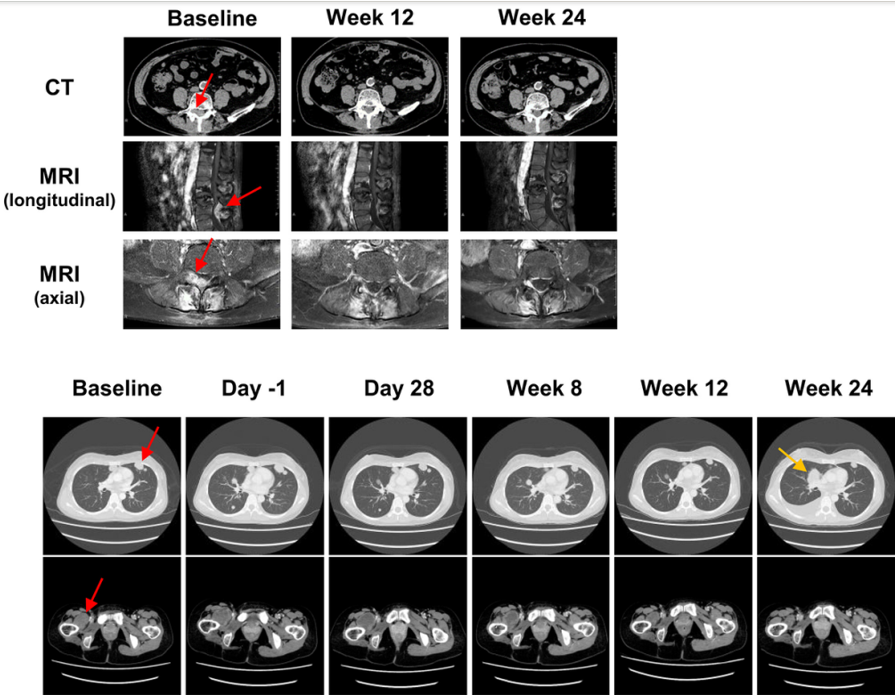
攻克癌症的“神奇钥匙”!TCR-T细胞治疗让胰腺癌、肺癌、黑色素瘤、肉瘤退缩
近年来,针对T细胞的CAR-T、TCR-T细胞疗法逐渐被大众熟知。其中工程化T细胞疗法(TCR-T)通过基因工程技术,将能够识别特定癌症抗原的TCR基因导入患者的T细胞中,使这些T细胞发挥特异性识别和杀伤肿瘤细胞的作用,以此来达到抗癌的目的。
免疫管家 2024-12-23

肾移植患者的抗癌反转,开启癌症免疫治疗时代!TCR-T细胞疗法大显神威
T细胞是人体免疫系统中的重要细胞之一,TCR-T细胞免疫治疗便是通过基因工程技术将能够识别特定癌症抗原的TCR基因导入患者的T细胞中,使这些T细胞发挥特异性识别和杀伤肿瘤细胞的作用。目前已经在诸如黑色素瘤、滑膜肉瘤、结直肠癌、肝癌、肺癌……实体肿瘤的试验中取得积极数据。
免疫管家 2024-12-06