西达基奥仑赛(英文商品名:CARVYKTI®,英文通用名ciltacabtagene autoleucel,简称Cilta-cel)
CARVYKTI®是传奇生物自主研发的一款具有两种靶向B细胞成熟抗原(BCMA)单域抗体的嵌合抗原受体 (CAR) T细胞免疫疗法。
2022年2月,美国FDA正式批准西达基奥仑赛(英文商品名:CARVYKTI®,英文通用名ciltacabtagene autoleucel,简称Cilta-cel)上市,用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者。这是全球第二款获FDA批准的BCMA CAR-T,也是首款获FDA批准的国产CAR-T细胞疗法。
根据2023年欧洲血液学协会(EHA)大会上公布的1b/2期CARTITUDE-1研究(NCT03548207)的最终结果显示:总缓解率(ORR)高达97.9%,其中包括82.5%的严格完全缓解(CR)患者。此外,12.4%的患者有非常好的部分缓解,3.1%的患者经历了部分缓解(PR)。中位无进展生存期(PFS)为34.9个月,中位缓解持续时间(DOR)为 33.9 个月。
2024年4月6日,美国食品药品监督管理局(FDA)已批准西达基奥仑赛 (cilta-cel,一种CAR-T 细胞疗法)用于治疗既往接受过至少 1 种治疗(包括蛋白酶体抑制剂和免疫调节剂)且对来那度胺难治的复发/难治性多发性骨髓瘤成人患者。值得注意的是西达基奥仑赛是全球首个且唯一获批用于多发性骨髓瘤患者二线治疗的B细胞成熟抗原(BCMA)靶向疗法。

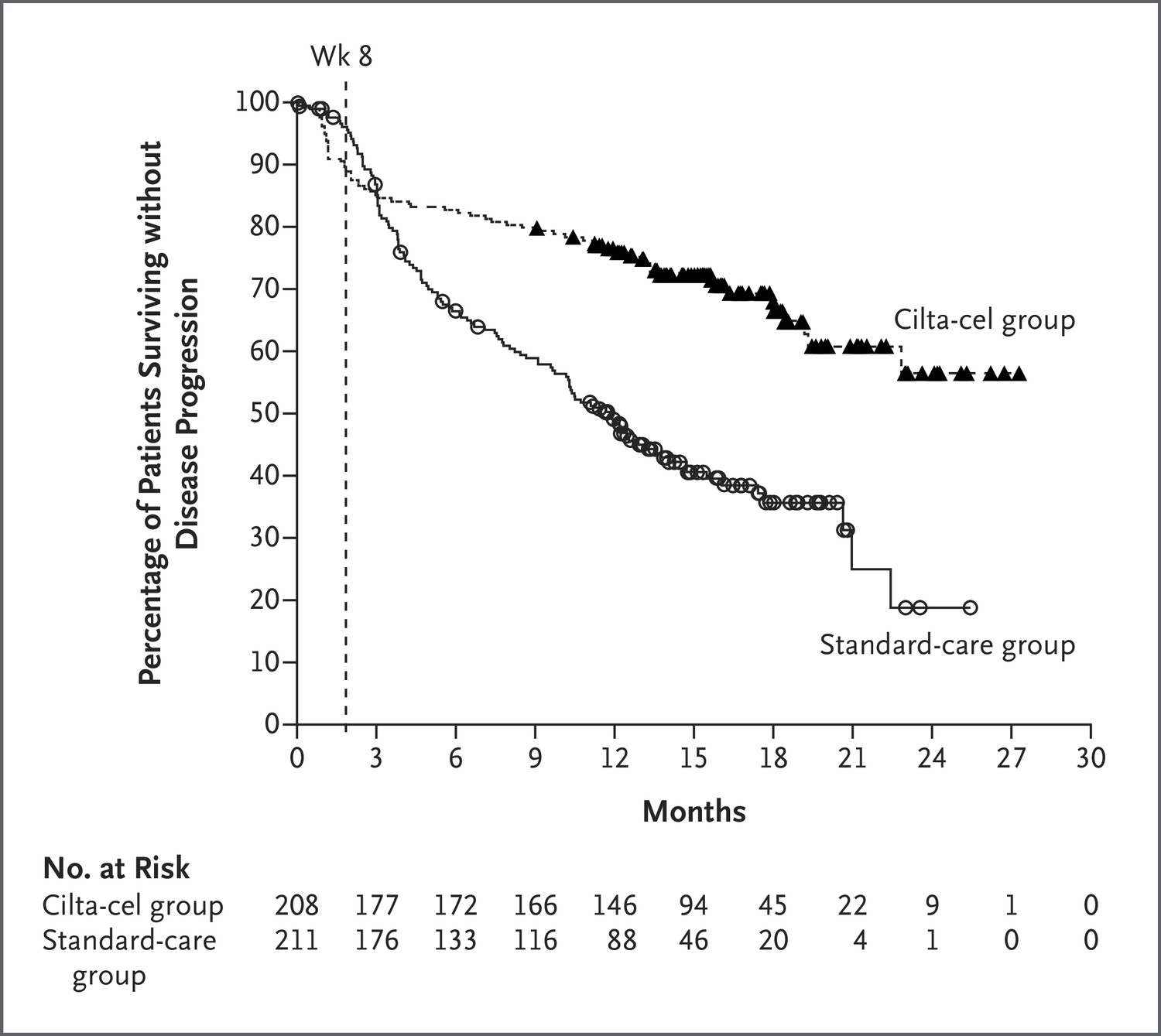
该批准是基于 3 期 CARTITUDE-4 试验 (NCT04181827) 的结果,该研究最初在 2023 年美国临床肿瘤学会年会上公布并发表在《新英格兰医学杂志》上。

试验结果显示:cilta- cell组的无进展生存率为75.9%,标准治疗组为48.6%;cilta- cell组比标准治疗组有更多的患者完全缓解或更好(73.1% vs. 21.8%),总体缓解(部分缓解或更好)分别为84.6%和67.3%,在有反应的患者中,cilta- cell组估计有84.7%的患者持续至少12个月有反应,而标准治疗组为63.0%。

相关推荐
随便看看
- 美国食品药品监督管理局(FDA)授予ADI-270快速通道指定用于治疗透明细胞肾细胞癌(ccRCC)
- 镥[177Lu]特昔维匹肽注射液纳入优先审评
- KRAS抑制剂 JMKX001899 片拟纳入优先审评
- 辉瑞PARP抑制剂甲苯磺酸他拉唑帕利胶囊获批用于前列腺癌
- 美国FDA批准达雷妥尤单抗方案用于治疗多发性骨髓瘤患者
- ADC药物CRB-701(SYS6002)首次人体剂量递增临床研究亮相ASCO GU
- selpercatinib(Retevmo、塞尔帕替尼)获批
- 贝伐珠单抗Bevacizumab
- 甲磺酸伏美替尼片拟纳入优先审评
- Belzutifan(贝组替凡,Welireg)治疗肾细胞癌的III期LITESPARK-005试验结果登《新英格兰医学杂志》











