相关推荐
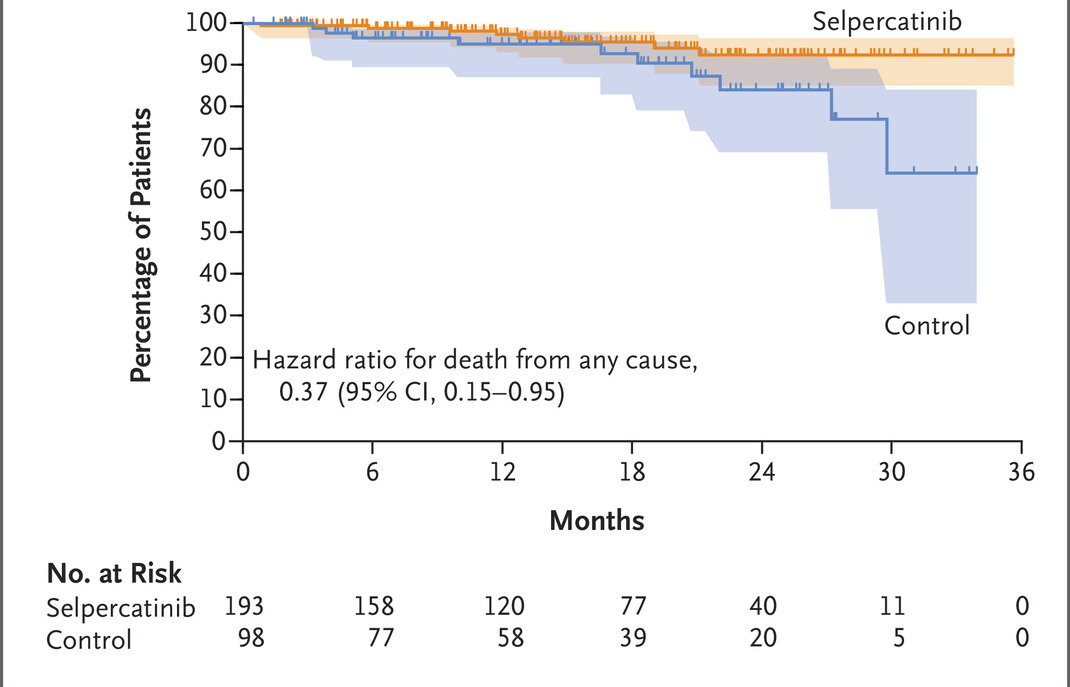
塞普替尼(Retevmo,Selpercatinib)治疗 RET 融合阳性非小细胞肺癌的I/II 期LIBRETTO-001试验最新结果
2月21日,《Journal of Clinical Oncology》发表了塞普替尼(Retevmo,Selpercatinib)治疗 RET 融合阳性非小细胞肺癌的I/II 期LIBRETTO-001试验最新结果。
免疫管家 2025-02-22

美国FDA批准礼来公司的塞普替尼(Retevmo)用于甲状腺髓样癌患者
9月27日,美国食品药品监督管理局(FDA)批准塞普替尼(Retevmo)用于2 岁及以上既往接受过全身治疗的RET 突变的晚期或转移性甲状腺髓样癌(MTC)的成人和儿童患者。
免疫管家 2024-09-29
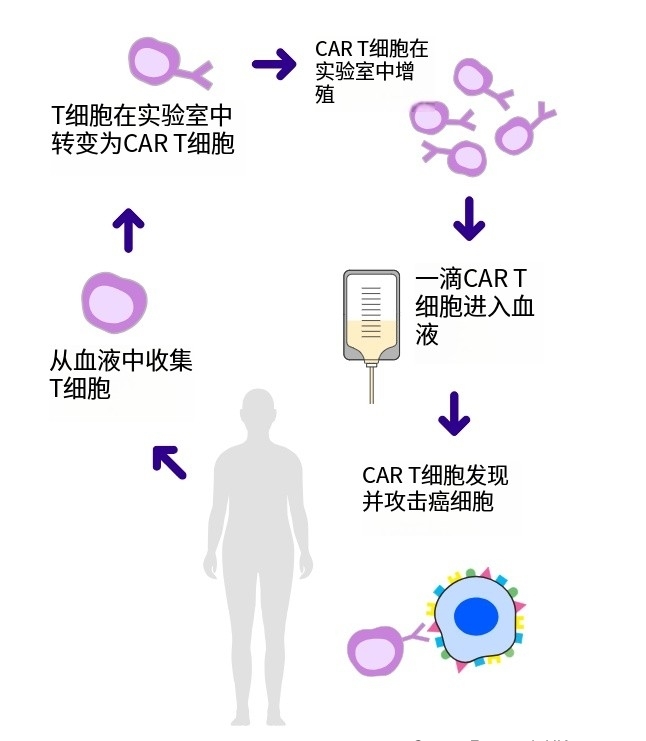
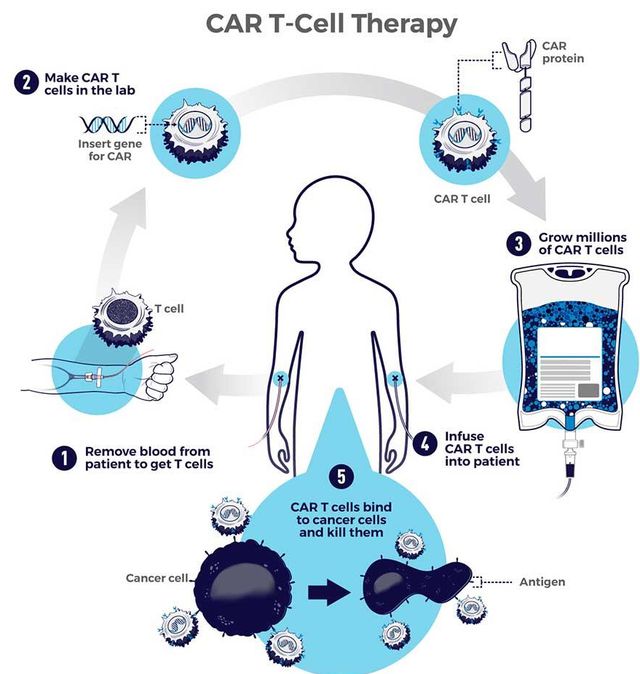
CAR-T技术进化:全球4.5万癌症患者已接受治疗,病情进展风险直降63%
嵌合抗原受体T细胞疗法(简称CAR-T细胞疗法)是当前个性化癌症治疗领域的前沿技术。2025年,Carl June、Bruce Levine、Isabelle Rivière和Michel Sadelain因开发这一开创性个性化癌症免疫疗法,共同荣获Richard N. Merkin生物医学技术奖。该技术通过改造患者自...
免疫管家 2025-05-27

88.9%肿瘤大幅缩小!CAR-T治疗方案临床数据震撼公布,癌症患者迎来转机
近日,在美国芝加哥举办的全球肿瘤学顶级盛会-美国癌症研究协会(AACR)年会上,一项来自德克萨斯大学MD安德森癌症中心的研究成果引发轰动。其研发的CAR-T细胞疗法AIC100在治疗晚期甲状腺癌的I期临床试验中,展现出50%的客观缓解率,为实体瘤治疗带来新的曙光。
免疫管家 2025-05-12

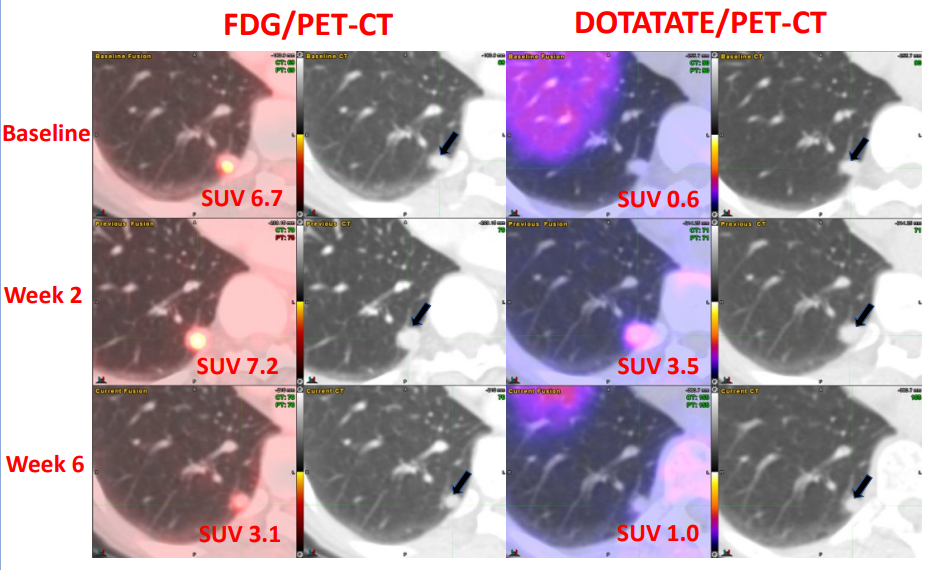
新型CAR-T细胞疗法AIC100使晚期甲状腺癌患者受益
美国癌症研究协会(AACR)年会是全球肿瘤学领域的顶级盛会,近日,2025年第116届AACR年会在美国芝加哥举行。此次会议上,德克萨斯大学 MD 安德森癌症中心的研究人员称,一种名为 AIC100 的新型嵌合抗原受体(CAR)T细胞疗法靶向 ICAM-1 蛋白,在两种晚期甲状腺癌患者中表现出令人鼓舞的反应和可接受的安...
免疫管家 2025-05-09

从全身转移到肿瘤消退52%!NTRK抑制剂如何实现跨癌种治疗?
NTRK(神经营养因子受体酪氨酸激酶)基因家族包括NTRK1、NTRK2、NTRK3,分别编码TRKA、TRKB、TRKC蛋白。这些蛋白在神经系统的发育和功能中起重要作用。
免疫管家 2025-04-17
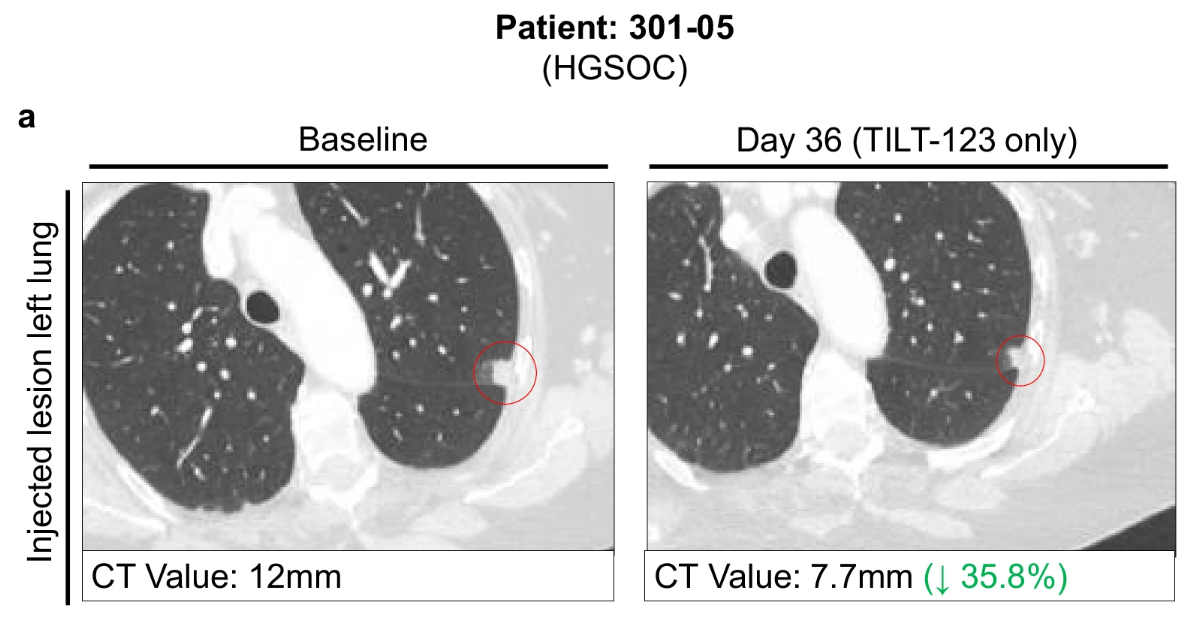
无病生存!溶瘤病毒TILT-123 神奇“组合拳”让卵巢癌、黑色素瘤、甲状腺癌、胰腺癌等“节节败退”
2月5日,《自然医学》发表了溶瘤腺病毒TILT-123联合帕博利珠单抗治疗铂类耐药或难治性卵巢癌的1a期 PROTA 试验数据。
免疫管家 2025-03-04
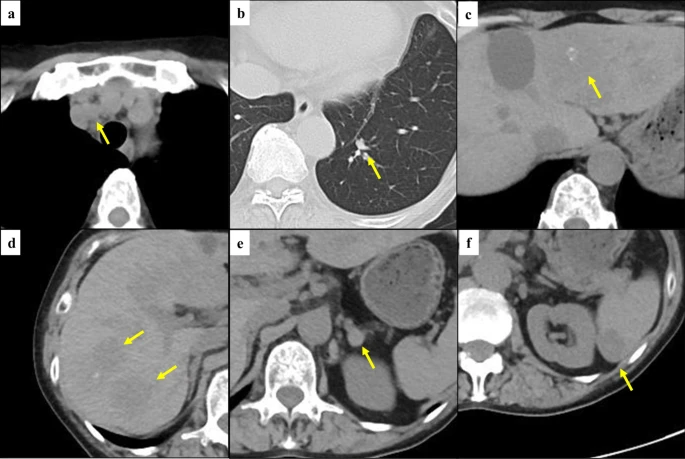
不限癌种!拉罗替尼有效缓解NTRK融合肉瘤、甲状腺癌、乳腺癌病情
神经营养原肌球蛋白激酶受体(NTRK)是近年来肿瘤研究领域的热点之一,包含NTRK1、NTRK2 和 NTRK3,分别编码原肌球蛋白受体激酶(TRK)家族TRKA、TRKB 和 TRKC 三种蛋白。任何一个基因如果和其他的基因发生了融合突变,那么就会导致癌细胞异常活性,驱动肿瘤的发生。
免疫管家 2025-02-11

抗癌“神药”拉罗替尼,成功通过谈判进入医保,让各类NTRK融合肿瘤患者病情缓解
12月9日,《Journal of Clinical Oncology》发表了拉罗替尼用于新诊断的婴儿纤维肉瘤(IFS)及其他NTRK融合阳性儿童肿瘤的研究结果。
免疫管家 2024-12-12
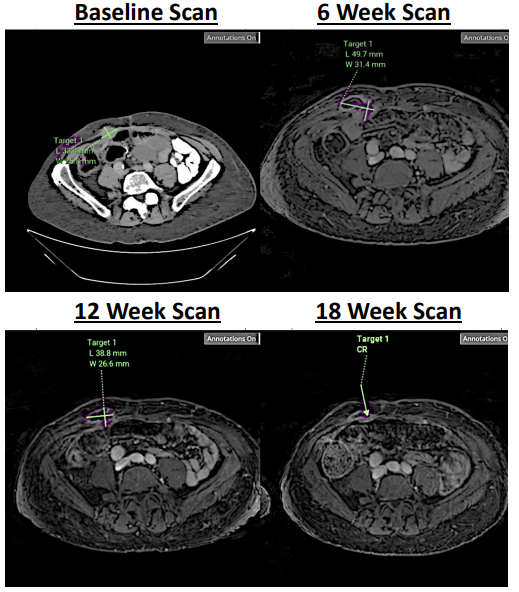
奇迹!溶瘤病毒让癌症细胞无所遁形,溶瘤病毒能否开启抗癌新时代?
随着人类对癌症的不断钻研,人们发现可以利用病毒来破坏癌细胞的正常功能,并可以对这些病毒进行基因工程改造,进而增强它们的选择性和安全性。所以溶瘤病毒(OVs)可以选择性地复制并破坏肿瘤细胞,同时保持正常细胞不受损,是一类很有前途的新兴抗癌免疫疗法。
免疫管家 2024-11-11