10月4日,BioNTech分享了PD-L1/VEGF-A 双特异性抗体候选药物 BNT327/PM8002的最新消息。
BNT327/PM8002 是一种双特异性抗体候选药物,结合了程序性细胞死亡配体-1 (“PD-L1”) 检查点抑制和血管内皮生长因子 A (“VEGF-A”) 中和作用。
2024 年 10 月,首例患者在一项多中心、开放标签的 2 期临床试验 (NCT06449222) 中给药,以评估两个剂量水平的 BNT327/PM8002 联合化疗在局部晚期/转移性三阴性乳腺癌 (“TNBC”) 患者一线和二线治疗中的安全性、有效性和药代动力学。这些数据将为一线 TNBC 的 3 期临床试验提供信息,该试验预计将于 2025 年开始。
2024 年 9 月,一项多中心、开放标签的 2 期临床试验 (NCT06449209) 中完成了首例患者给药,以评估 BNT327/PM8002 联合化疗在未经治疗的广泛期小细胞肺癌 (“ES-SCLC”) 患者以及一线或二线治疗后进展的 SCLC 患者中的疗效。这些数据将为一线 SCLC 的 3 期临床试验提供信息,该试验预计将于 2024 年开始。
一线非小细胞肺癌(NSCLC)的2/3期临床试验预计将于2024年启动。
2024 年 6 月,BNT327/PM8002 与 BNT325/DB-1305 联合用药的评估启动,BNT325/DB-1305 是一种滋养层细胞-表面抗原 2 (“TROP2”) 靶向抗体-药物偶联物 (“ADC”) 候选药物,作为正在进行的 1/2 期临床试验 (NCT05438329) 的一部分。该临床试验评估了 BNT325/DB-1305 单独使用和与 BNT327/PM8002 联合治疗各种实体瘤适应症的安全性和耐受性。计划于 2024 年开始新型 BNT327/PM8002 与专有 ADC 联合治疗的其他试验。
2024年9月,在欧洲肿瘤内科学会(ESMO)2024年年会上公布了三项评估BNT327/PM8002治疗晚期TNBC、表皮生长因子受体(EGFR)突变NSCLC和肾细胞癌(RCC)患者的临床试验数据:
1/2 期临床试验 (NCT05918133)评估了 BNT327/PM8002 联合化疗作为晚期或转移性三阴性乳腺癌 (TNBC)患者的一线治疗,共42例患者接受治疗,结果显示:78.6%的意向治疗人群肿瘤缩小或消失,其中1例完全缓解(CR),32例部分缓解(PR),7例患者病情稳定(SD),确认客观缓解率(cORR)为 73.8%,疾病控制率(DCR)为 95.2%,中位无进展生存期(PFS)为 13.3 个月。
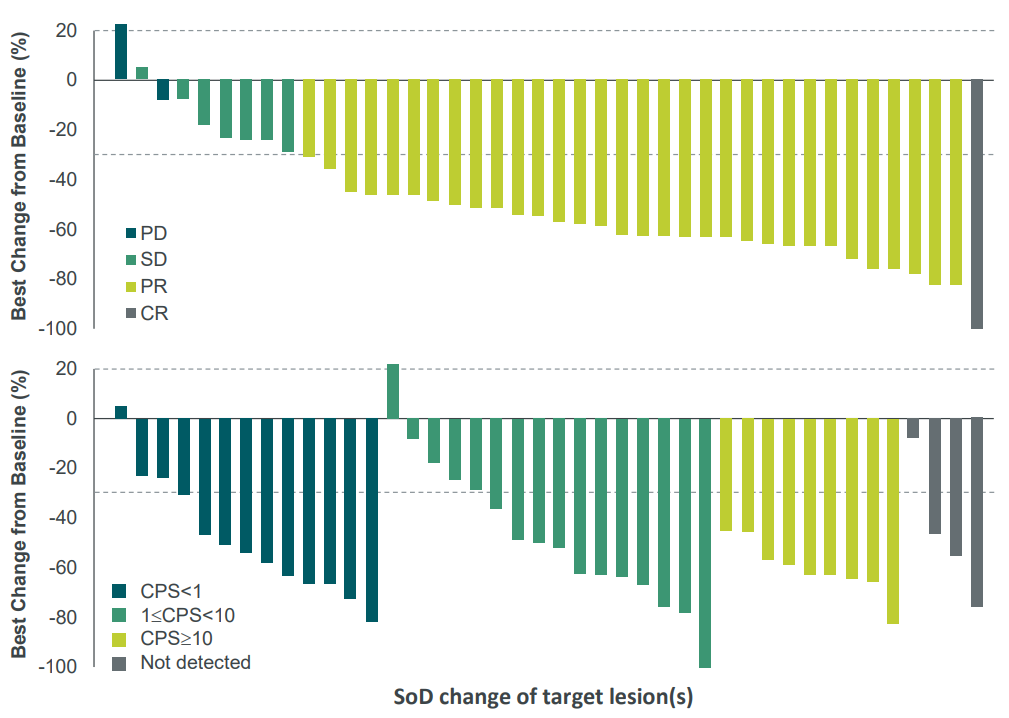
2 期临床试验 (NCT05756972)评估了 BNT327/PM8002 联合化疗在 EGFR-酪氨酸激酶抑制剂治疗后进展的晚期 EGFR 突变非小细胞肺癌(NSCLC)患者中的表现,共64例患者接受治疗,结果显示:60.9%的患者肿瘤缩小或消失,57.8%的患者确认实现客观缓解(cORR),37例患者实现部分缓解(PR),24例病情稳定(SD),疾病控制率(DCR)为95.3%。
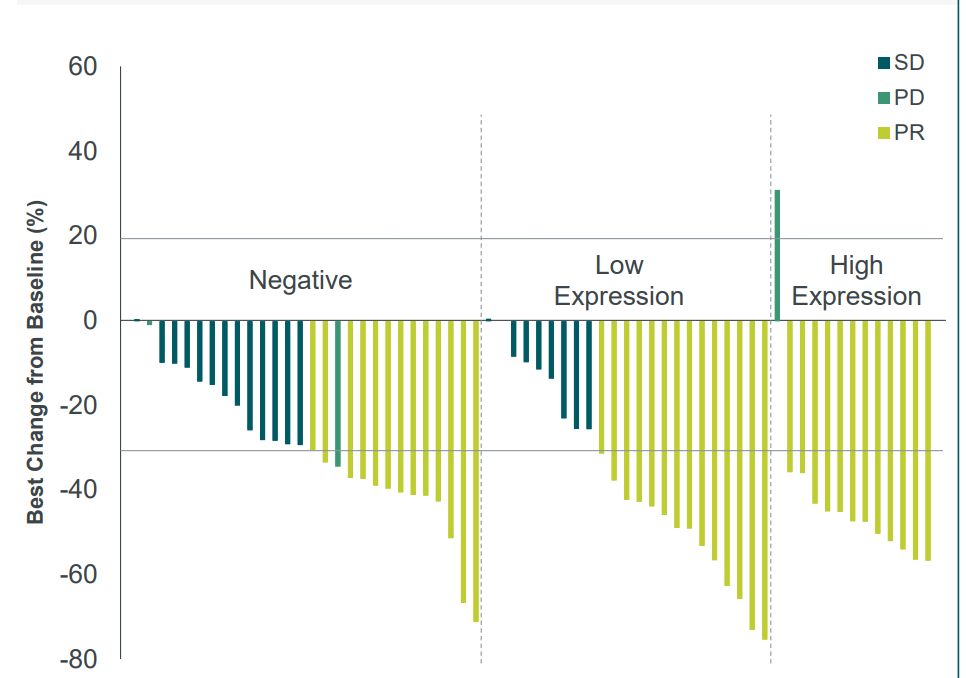
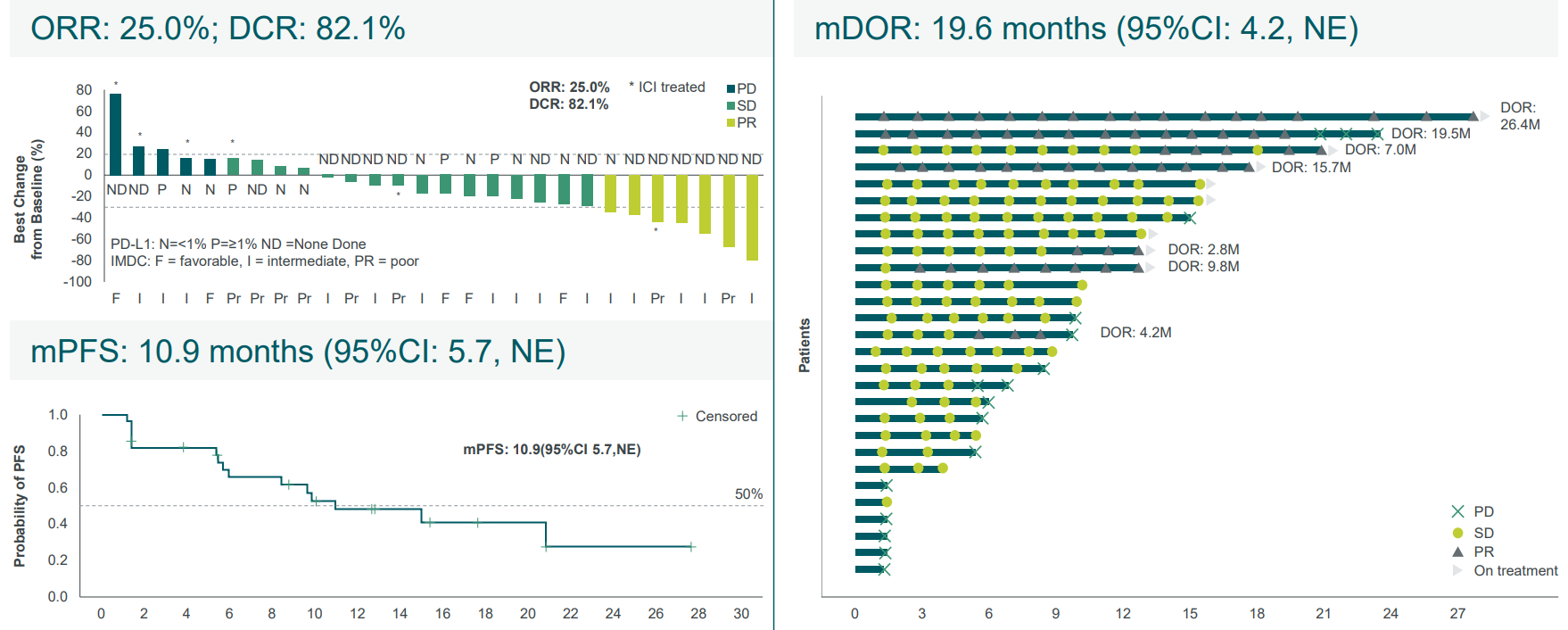
1/2 期临床试验 (NCT05918445)评估了 BNT327/PM8002 单药治疗既往未治疗的晚期非透明细胞肾细胞癌(RCC)或接受过治疗的晚期透明细胞肾细胞癌(ccRCC)患者中的疗效,28例患者接受治疗,结果显示:客观缓解率(ORR)为25.0%,疾病控制率(DCR)为82.1%,中位缓解持续时间(DOR)为19.6个月,中位无进展生存期(PFS)为10.9个月,6个月无进展生存率为65.4%。
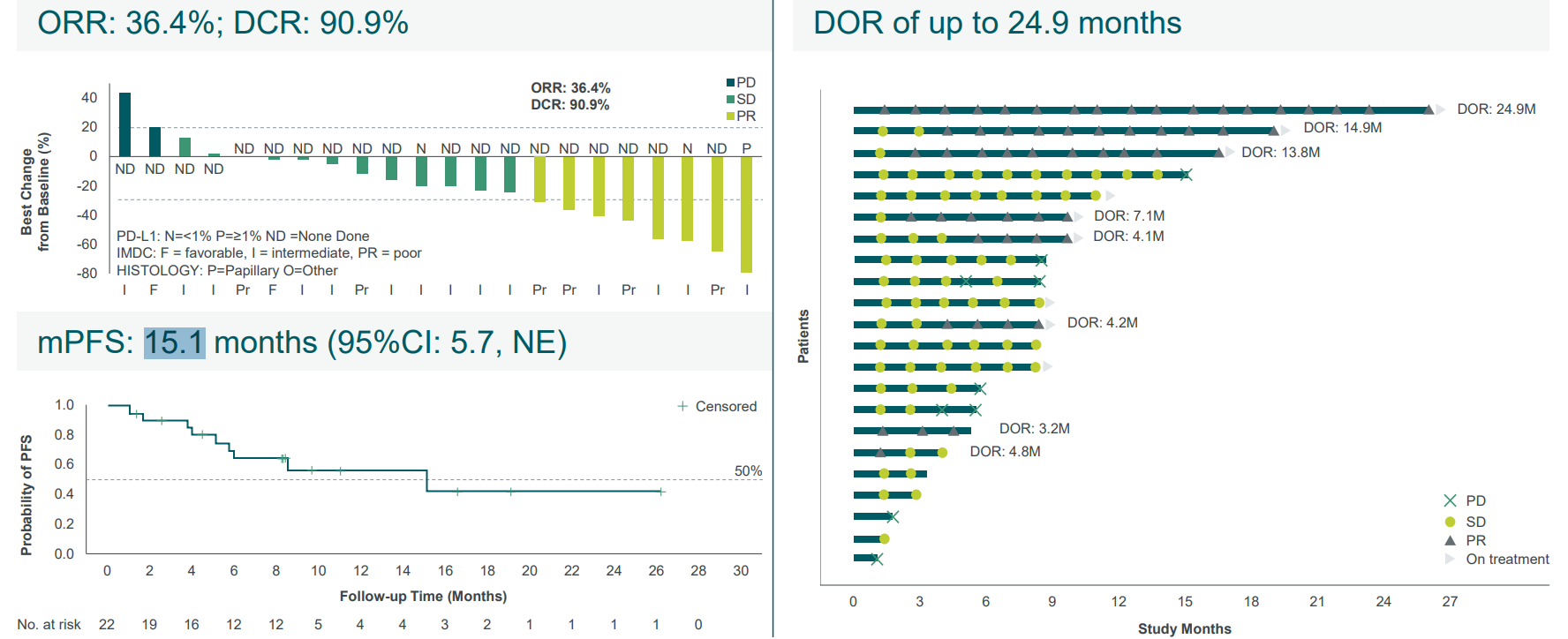
22例既往未接受过治疗的非透明细胞肾细胞癌 (nccRCC) 患者中,客观缓解率(ORR)为: 36.4%,疾病控制率(DCR)为90.9%,缓解持续时间(DOR)最长为24.9个月,中位无进展生存期(PFS)为15.1个月,6个月无进展生存率为74.4%。
目前有临床试验正在寻找实体瘤患者,患者可通过参加临床试验来接受药物治疗,临床试验对于传统疗法无效或疗效较差的患者来说,可能带来新的希望和治疗机会。如果有需要或有兴趣了解临床试验的患者可以联系康和源免疫之家医学部(400-880-3716)。
参考资料
https://investors.biontech.de/static-files/774eb00b-2bb9-416e-8470-c465210101e5

相关推荐
随便看看
- 安罗替尼联合派安普利单抗为晚期肝细胞癌患者提供了新的治疗选择
- 双特异性抗体Linvoseltamab治疗复发/难治性多发性骨髓瘤
- JBI-778 在实体瘤中的 I 期临床试验中实现首批患者给药
- 美国FDA批准inavolisib用于乳腺癌
- 石药集团携五项创新成果亮相2025 ASCO年会:聚焦结直肠癌、骨肉瘤与胃肠道肿瘤治疗突破
- 溃疡性结肠炎的IL-23p19靶点药物初见锋芒
- 阿昔替尼 英立达 Axitinib(Inlyta)
- 收藏 | 不能错过的胃癌的药物治疗大全!
- ADC药物德曲妥珠单抗(DS-8201,Enhertu,T-Dxd,优赫得)获批胃癌
- 阿米吡啶 Amifampridine(Ruzurgi)











