12月13日,美国食品药品监督管理局(FDA)批准cosibelimab-ipdl (Unloxcyt)用于治疗无法接受根治性手术或根治性放疗的转移性皮肤鳞状细胞癌(mCSCC)或局部晚期皮肤鳞状细胞癌(laCSCC)成人患者。

cosibelimab是一种潜在分化、高亲和力、全人源 IgG1 亚型单克隆抗体,可直接与 PD-L1 结合并阻断 PD-L1 与程序性死亡受体-1(“PD-1”)和 B7.1 受体的相互作用。
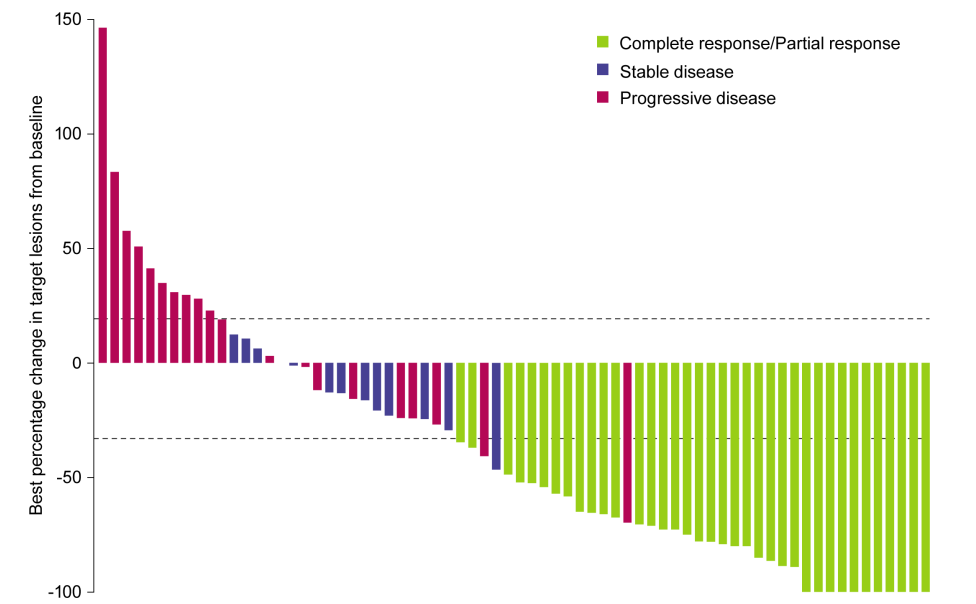
此次批准主要基于 CK-301-101(NCT03212404) ,该试验共纳入78例患者,结果显示:47.4%的患者观察到目标病灶稳定而持久地减少,在37例有客观反应的患者中,6例患者达到完全缓解(CR),31例达到部分缓解(PR),12例病情稳定(SD)。中位缓解持续时间(DOR)未达到,估计88.9%的患者缓解持续时间达到6个月,73.0%的患者缓解持续时间达到1年,73.0%的患者缓解持续时间达到2年!
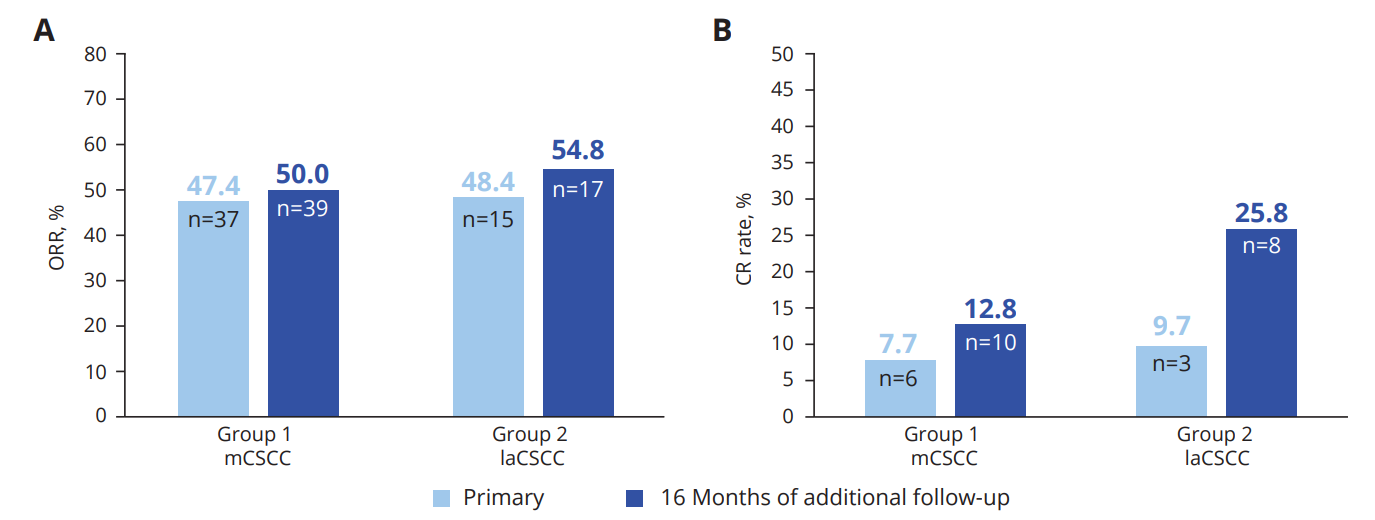
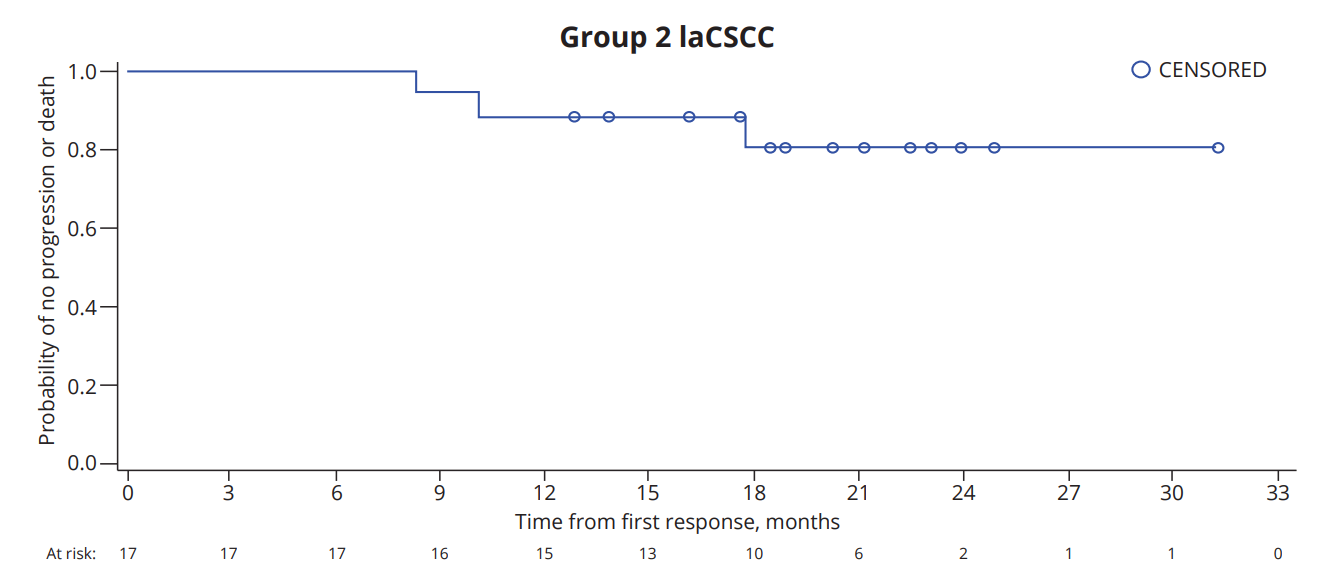
2024 年欧洲肿瘤内科学会 (“ESMO”) 年会上公布了 cosibelimab 用于局部晚期和转移性皮肤鳞状细胞癌(cSCC)的关键试验的长期数据。cosibelimab在 109 例晚期局部晚期和转移性皮肤鳞状细胞癌(cSCC)中的客观缓解率 (“ORR”) 和完全缓解率有所提高。局部晚期和转移性 cSCC 的 ORR 分别为 54.8% 和 50.0%,局部晚期和转移性 cSCC 的完全缓解率分别为 25.8% 和 12.8%。
队列1中,78例患者有50%的患者实现肿瘤缩小或消失,10例患者完全缓解(CR),29例患者部分缓解(PR),11例患者病情稳定(SD)。
队列2中,31患者有54.8%的患者实现肿瘤缩小或消失,8例患者完全缓解(CR),9例患者部分缓解(PR),10例患者病情稳定(SD)。
临床试验对于传统疗法无效或疗效较差的患者来说,是寻找新的治疗药物和方法的,最快最安全的途径,可能带来新的希望和治疗机会,并能大大减轻家庭经济负担。目前有临床试验正在寻找患者,患者可通过参加临床试验来接受药物治疗,病历资料审核通过后可免费入组接受治疗。对临床试验有兴趣或需要帮助的患者可提交病历资料至康和源免疫之家(400-880-3716)来寻找适合的临床研究。
参考资料
1.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-cosibelimab-ipdl-metastatic-or-locally-advanced-cutaneous-squamous-cell-carcinoma
2.https://pmc.ncbi.nlm.nih.gov/articles/PMC10582968/
3.https://checkpointtx.com/wp-content/uploads/2024/09/1136P_Cosibelimab_ESMO_2024_Poster.pdf

相关推荐
随便看看
- 靶向HER2的ADC药物GQ1005、DS-8201为实体瘤患者带来新治疗选择
- 胰腺癌患者福音!Namodenoson获孤儿药资格认定!实现肝细胞癌患者生存超6年!
- 欧盟委员会批准特瑞普利单抗治疗鼻咽癌和食管鳞癌
- 多西他赛Taxotere Docetaxel 泰索帝
- 他泽司他新药上市申请获受理并获纳入优先审评
- 吡昔替尼胶囊(PLX3397)拟纳入优先审评,用于症状性腱鞘巨细胞瘤
- 安罗替尼 福可维 Anlotinib Hydrochloride
- 宜联生物与安进达成合作协议,评估ADC药物YL201联合IMDELLTRA™用于广泛期小细胞肺癌的潜力
- 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 美国FDA批准asciminib(Scemblix)用于新诊断的慢性期费城染色体阳性慢性粒细胞白血病