10月29日,美国食品药品监督管理局(FDA)加速批准asciminib(Scemblix)用于新诊断的慢性期费城染色体阳性慢性粒细胞白血病(Ph+ CML)成人患者。

截图源于参考资料1
此次批准主要基于III期ASC4FIRST (NCT04971226)试验的积极结果,该试验评估了 asciminib在新诊断的慢性期费城染色体阳性慢性粒细胞白血病(Ph+ CML)患者中的疗效。共纳入405例患者,201例患者接受asciminib治疗,204例患者接受对照组治疗,结果显示:具有主要分子反应的百分比分别为 69.3% 和 40.2%,第 48 周时 asciminib 组出现主要分子反应的患者百分比为 66.0%,对照组为57.8%。
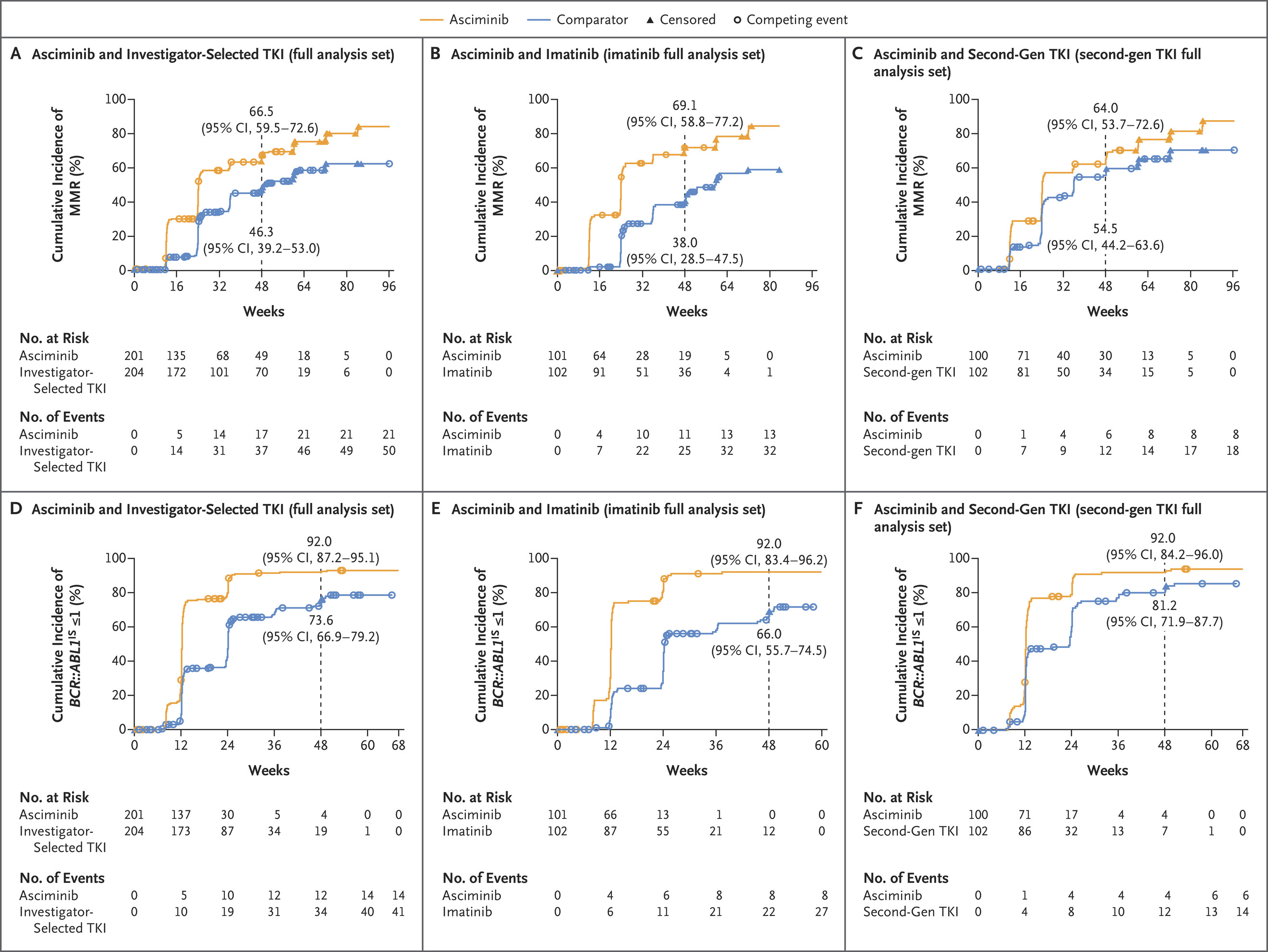
截图源于参考资料2
该试验中, asciminib在新诊断的慢性期费城染色体阳性慢性粒细胞白血病(Ph+ CML)患者中显示出卓越的疗效。
Scemblix是首个通过特异性靶向ABL豆蔻酰基口袋发挥作用的STAMP抑制剂,其设计具有高度特异性,最小化脱靶效应,与当前标准治疗相比,其安全性和耐受性得到改善。2021年10月,Scemblix在美国获批上市,用于治疗接受过两种或多种TKI治疗或具有T315I突变新诊断的慢性期费城染色体阳性慢性粒细胞白血病成人患者。
慢性髓性白血病(CML)也称为慢性粒细胞白血病,是白血病中比较常见的类型之一,也是一种影响血液及骨髓的恶性肿瘤。该病进展缓慢,主要表现为贫血、反复感染、脾大,有一定的出血倾向等慢粒的病因仍未明确,但与费城染色体密切相关,约90-95%的患者出现费城染色体。
临床试验对于传统疗法无效或疗效较差的患者来说,是寻找新的治疗药物和方法的,最快最安全的途径,可能带来新的希望和治疗机会,并能大大减轻家庭经济负担。目前有临床试验正在寻找白血病患者,患者可通过参加临床试验来接受药物治疗,病历资料审核通过后可免费入组接受治疗。对临床试验有兴趣或需要帮助的患者可提交病历资料至康和源免疫之家(400-880-3716)来寻找适合的临床研究。
参考资料
1.https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-asciminib-newly-diagnosed-chronic-myeloid-leukemia
2.https://www.nejm.org/doi/full/10.1056/NEJMoa2400858

相关推荐
随便看看
- 乐伐替尼/仑伐替尼 乐卫玛 Lenvatinib(Lenvima)
- 尼拉帕利,尼拉帕尼 则乐 Niraparib(Zejula)
- 总生存率高达99%!纳武利尤单抗联合AVD化疗方案延长霍奇金淋巴瘤患者无进展生存期
- PD-1抑制剂替雷利珠单抗在国内获批非小细胞肺癌
- 莫博赛替尼 Mobocertinib(TAK-788,商品名EXKIVITY)
- 颅内疾病控制率100%!ROS1抑制剂他雷替尼新药上市申请受理,非小细胞肺癌新的治疗选择
- 伯瑞替尼(万比锐 Vebreltinib Enteric Capsules)
- 欧盟委员会批准埃万妥单抗联合化疗用于治疗非小细胞肺癌
- BMS-986156联合伊匹木单抗或纳武利尤单抗联合或不联合立体定向消融放疗治疗晚期实体瘤患者的I/II 期研究
- 艾伯维向美国FDA提交Teliso-V生物制剂许可申请用于非鳞状非小细胞肺癌