相关推荐

映恩生物B7H3 ADC DB-1311/BNT324及HER3 ADC DB-1310的两项研究结果在2025 ASCO 展现鼓舞性效果
2025年美国临床肿瘤学会(ASCO)年会在芝加哥隆重召开,作为全球最具影响力的肿瘤学盛会,每年都会吸引来自世界各地的顶尖肿瘤专家、学者、科研人员以及药企代表齐聚一堂。在这里,他们分享最新的研究成果、探讨最前沿的治疗理念,共同推动肿瘤治疗技术的不断进步。此次会议上公布了多项突破性研究。其中,映恩生物B7H3 ADC D...
免疫管家 2025-06-05
![镥[177Lu]特昔维匹肽注射液纳入优先审评](http://myimm-manager.oss-cn-beijing.aliyuncs.com/uploads/allimg/20250516/1-250516105039505.png)
镥[177Lu]特昔维匹肽注射液纳入优先审评
4月29日,国家药品监督管理局药品审评中心(CDE)显示:诺华制药申请的镥[177Lu]特昔维匹肽注射液纳入优先审评,用于治疗既往接受过雄激素受体通路抑制剂(ARPI)治疗的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)成年患者。
免疫管家 2025-05-16

《临床肿瘤学杂志》发表了 FG-3246 在转移性去势抵抗性前列腺癌患者中的 1 期单药治疗研究结果
3月26日,FibroGen在《临床肿瘤学杂志》上发表了FOR46(FG-3246)用于转移性去势抵抗性前列腺癌患者的I 期首次人体研究。
免疫管家 2025-04-01

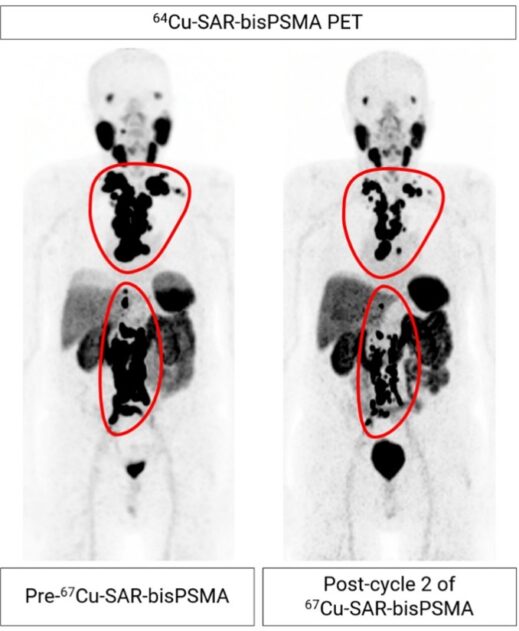
FDA 扩大了 Pluvicto 的转移性去势抵抗性前列腺癌适应症
2025年3月28日,美国食品药品监督管理局(FDA)批准Pluvicto(lutetium Lu 177 vipivotide tetraxetan,镥[177Lu] 特昔维匹肽)用于前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者,这些患者已接受雄激素受体通路抑制剂(ARPI)治疗且被认...
免疫管家 2025-03-31

辉瑞PARP抑制剂甲苯磺酸他拉唑帕利胶囊获批用于前列腺癌
10月29日,泰泽纳®(TALZENNA®,甲苯磺酸他拉唑帕利胶囊)获得国家药品监督管理局(NMPA)批准联合恩扎卢胺用于HRR基因突变的转移性去势抵抗性前列腺癌 (mCRPC) 成人患者。
免疫管家 2024-11-07