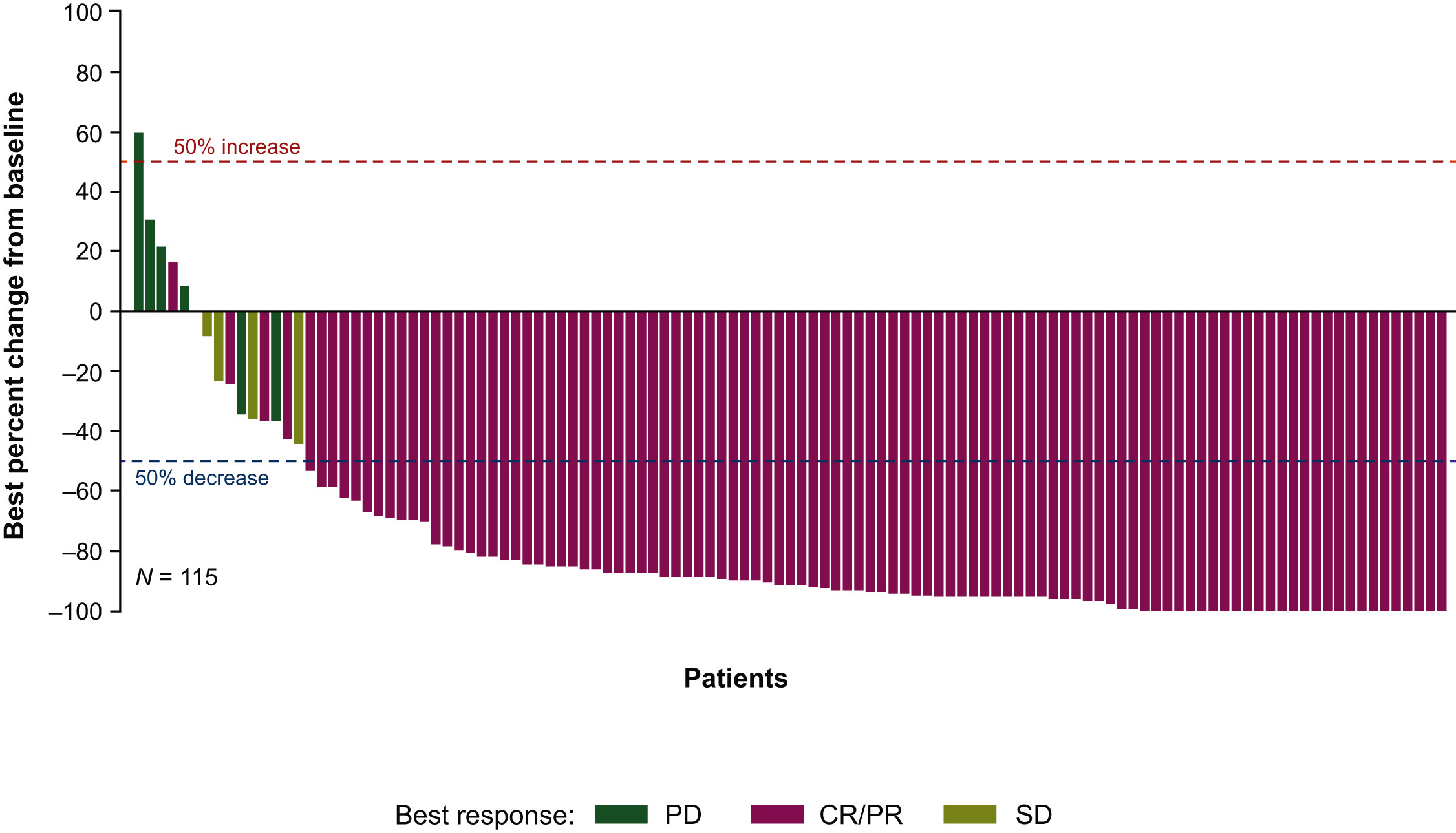
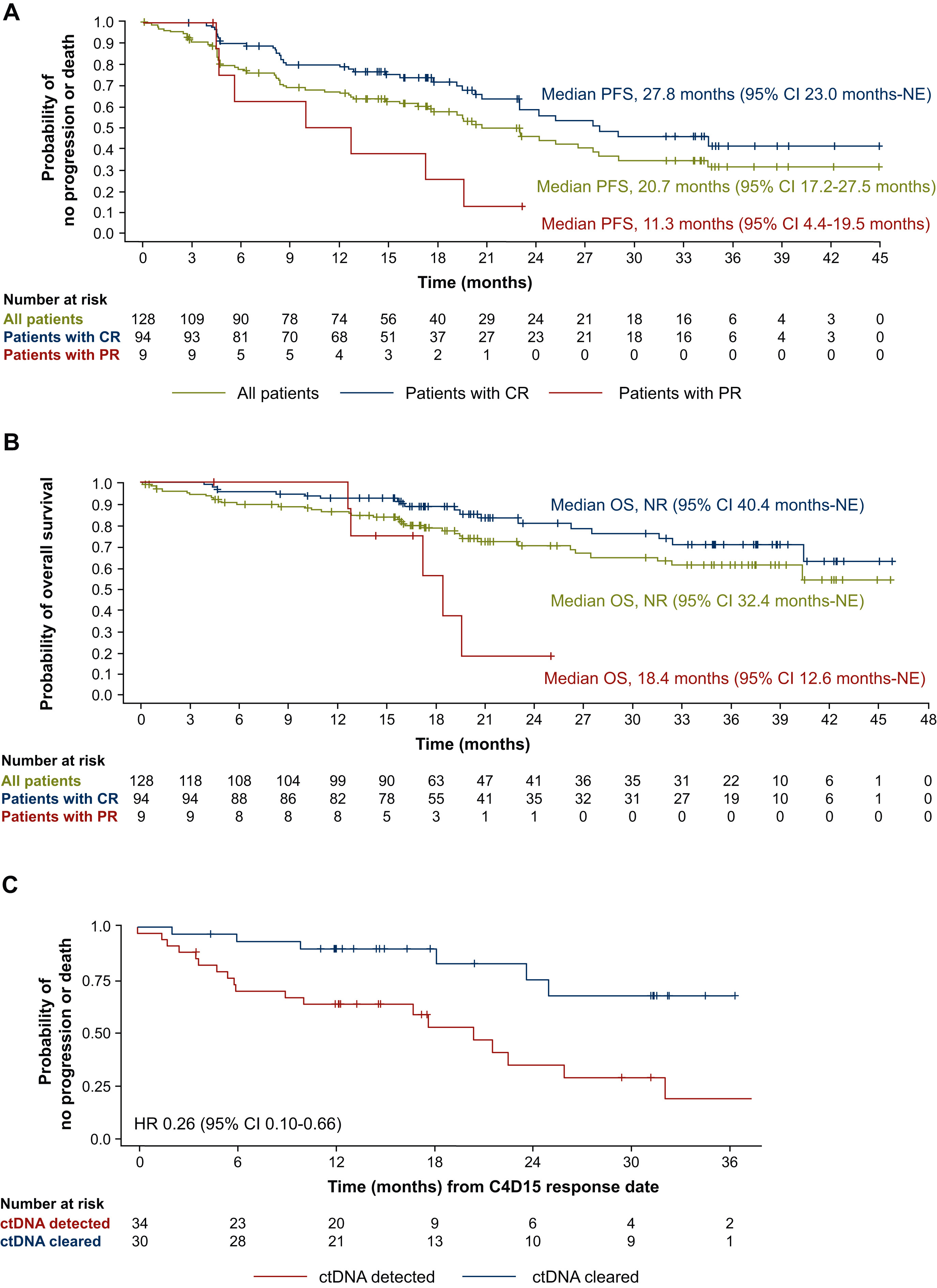
相关推荐

信诺维EZH2抑制剂-XNW5004的最新研究成果将亮相2025年ICML大会
近日,信诺维医药宣布其自主研发的创新药EZH2抑制剂-XNW5004的最新研究成果成功入选2025 年第18届国际恶性淋巴瘤会议(18th-ICML),并将在此次会议上进行口头报告。
免疫管家 2025-05-09

瑞奥基仑赛治疗复发/难治性 滤泡淋巴瘤更好的生存获益
近日,天津医科大学肿瘤医院张会来/王先火教授团队开展的通过倾向性评分匹配(PSM)和间接治疗比较的方法,分析瑞基奥仑赛与常规治疗在复发性/难治性 (r/r) 滤泡性淋巴瘤(FL)患者中的疗效差异的研究发表于《Hematological Oncology》。
免疫管家 2025-04-08
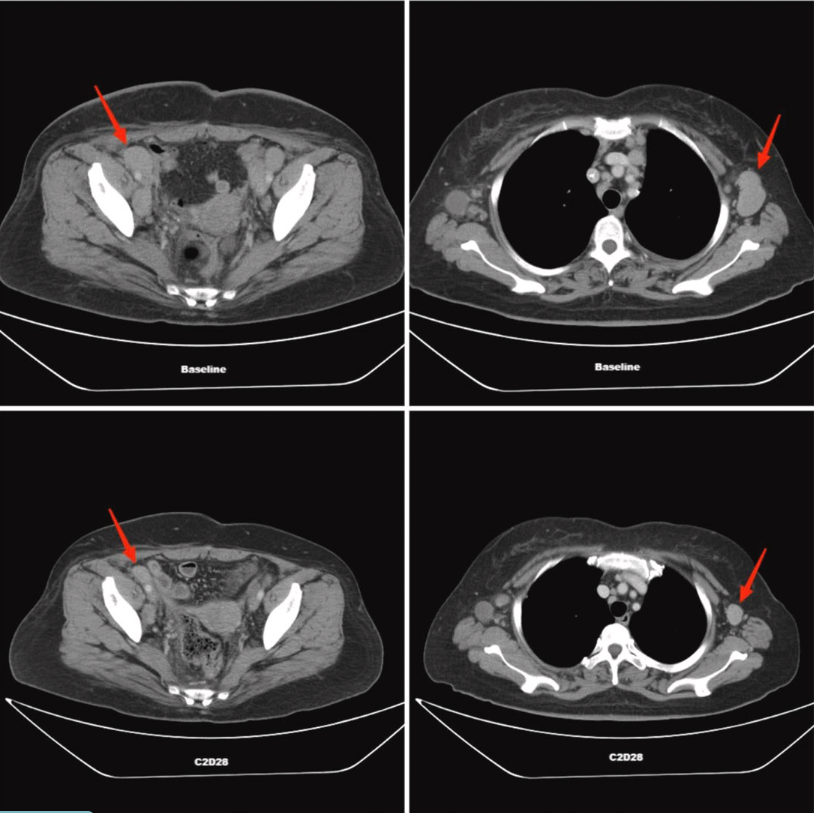
EZH2抑制剂XNW5004获得临床试验批准
2月12日,信诺维医药自主研发的创新药EZH2 抑制剂XNW5004获得国家药品监督管理局(NMPA)临床试验批准,将于近期开展XNW5004联合CHOP/CHOEP拟用于治疗初治外周T细胞淋巴瘤(PTCL)的Ib/II期临床研究。
免疫管家 2025-02-24