抗CD19嵌合抗原受体(CAR) T细胞疗法可引起严重的细胞因子释放综合征(CRS)和神经毒性,阻碍其治疗应用。在这里,研究人员产生了一个新的抗CD19 CAR分子(CD19-BBz(86)),来自CD19-BBz原型,携带共刺激4-1BB和CD3ζ结构域。研究人员发现CD19-BBz(86) CAR - T细胞产生较低水平的细胞因子,表达较高水平的抗凋亡分子,并且比原型CD19-BBz CAR - T细胞增殖更慢,尽管它们保留了有效的细胞溶解活性。研究人员对B细胞淋巴瘤患者进行了CD19-BBz(86) CAR - T细胞治疗的一期试验(ClinicalTrials.gov标识符NCT02842138)。11例接受2 × 108 - 4 × 108 CD19-BBz(86) CAR - T细胞治疗的患者中有6例(54.5%)完全缓解。值得注意的是,在接受治疗的25名患者中,没有出现神经毒性或CRS(大于1级)。在接受治疗的患者中,包括那些完全缓解的患者,在CAR - T细胞输注后,血清细胞因子水平没有明显升高。CD19-BBz(86) CAR - T细胞在体内持续增殖并分化为记忆细胞。因此,使用新的CD19-BBz(86) CAR - T细胞治疗产生有效和持久的抗淋巴瘤反应,而不会引起神经毒性或严重的CRS,代表了一种安全有效的抗cd19 CAR - T细胞治疗。
第二代抗cd19 CAR原型(CD19-BBz),携带FMC63单链变异片段(scFv)以及细胞内4-1BB共刺激和CD3ζ信号域,由CD8α序列连接,包括铰链和跨膜结构域,最初由Imai等人于2004年开发(参考文献)。1、2)。该CD19-BBz CAR构建体被克隆到慢病毒载体中用于临床前和临床研究,转导的CAR - T细胞后来被命名为CTL019 (Kymriah)。CTL019和其他抗cd19 CAR - T细胞在治疗复发或难治性B细胞淋巴瘤和白血病方面是有效的,但它们通常会引起严重的毒性,包括CRS和神经毒性,这与血清中炎症细胞因子水平的显著升高有关。
为了产生一种安全的抗cd19 CAR - T细胞疗法,研究人员使用三级结构预测程序(Phrye2)20的指导,创建了一组具有代表性的CD19-BBz变体,在原型CD19-BBz CAR构建体(CD19-BBz(71)) 1-3中,基因改变编码CD8α分子细胞外和细胞内结构域的序列,并鉴定了产生细胞因子能力降低的CAR变体。研究人员发现,与CD19人肿瘤细胞相互作用时,与原型CD19- bbz(71)转导的T细胞相比,用CD19- bbz(86)变异CAR载体转导的T细胞产生的细胞因子水平显著降低,表达的抗凋亡分子水平更高。当T细胞与CD19肿瘤细胞相互作用时,CD19- bbz(86)转导的T细胞比CD19- bbz(71)转导的T细胞增殖更慢。尽管细胞因子产生减少,CD19- bbz (86) CAR - T细胞在体外和体内对CD19肿瘤细胞保持了有效的细胞溶解活性。CD19- bbz (86) CAR变体含有来自人CD8α的86个氨基酸片段。包括较长的细胞外结构域片段(55个氨基酸,而CD19-BBz原型中为45个氨基酸(71))和较长的细胞内序列(7个氨基酸,而CD19-BBz原型中为3个氨基酸(71))(图1a)。选择CD19-BBz(86)慢病毒载体共表达CD19-BBz(86)变体CAR和截断的无功能表皮生长因子受体(tEGFR)作为转导和抗egfr抗体介导的细胞消融的标记物17,21(图1a)进行进一步研究。
图1 CD19-BBz(86)转导的CAR - T细胞具有较低的细胞因子产生和较高的抗凋亡分子表达。
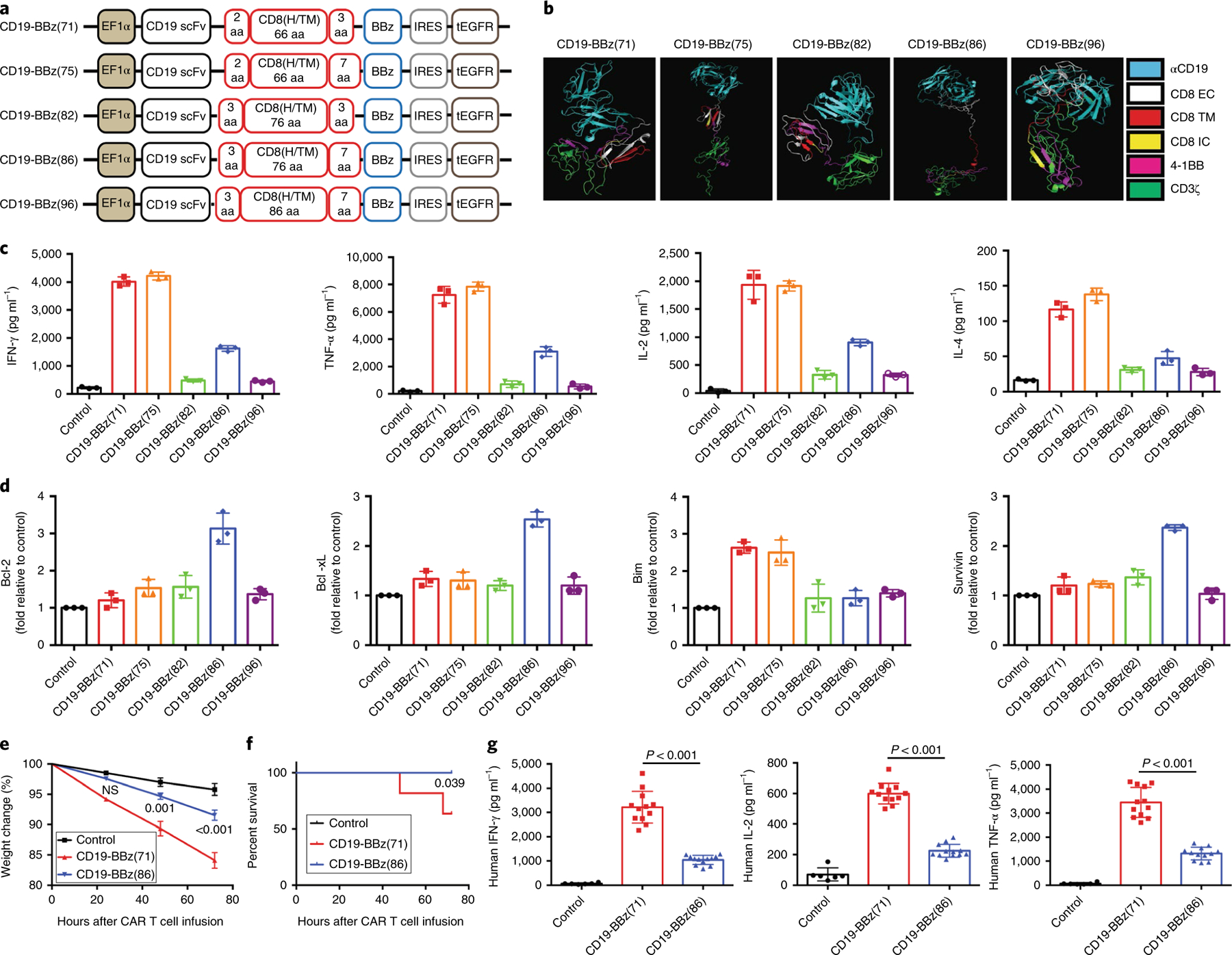
研究人员利用SCID-beige小鼠CRS22模型,评估了具有CD19-BBz变体(86)和原型CD19-BBz(71) CAR分子的CAR - T细胞在产生细胞因子和诱导CRS方面的差异。CD19-BBz(71) CAR - T细胞引起严重的CRS,与对照组相比,在很大一部分接受治疗的小鼠中导致显著的体重减轻和最终死亡(PBS)(图1e,f)。相比之下,CD19-BBz(86) CAR - T细胞不会引起CRS,与对照小鼠相比,所有接受这些细胞治疗的小鼠都存活了下来,体重也没有明显减轻。此外,用CD19-BBz(86) CAR - T细胞处理的小鼠血清中产生的人细胞因子浓度明显低于用CD19-BBz(71) CAR - T细胞处理的小鼠(图1g)。用CD19-BBz(86) CAR - T细胞处理的小鼠血清细胞因子水平也显著降低,细胞因子主要由被CAR - T细胞激活的宿主髓细胞产生22,23。研究人员还观察到,腹腔注射CD19-BBz(86) CAR - T细胞后,腹膜髓细胞数量和细胞因子mRNA水平有更适度的增加。这些体外和体内数据表明,CD19-BBz(86) CAR - T细胞保留了有效的细胞分解活性,产生促炎细胞因子的能力降低,招募和激活髓细胞的能力降低,不会引起携带肿瘤的SCID-beige小鼠的CRS。
研究人员对难治性B细胞淋巴瘤患者进行了CD19-BBz(86) CAR - T细胞治疗的一期试验。共有26名患者入组研究,其中25名患者接受了治疗。一名患者由于无法制造足够数量的CAR - T细胞而没有接受治疗。
在每名患者3-6 × 106个总CD19-BBz(86) CAR - T细胞的最低剂量下,6名患者中有3名获得了治疗反应。在每名患者6-19 × 107个CD19-BBz(86) CAR - T细胞的中剂量下,8名患者中有4名获得了部分缓解。在每名患者最高剂量为2 - 4 × 108个总CD19-BBz(86) CAR - T细胞时,11名患者中有6名获得完全缓解(54.5%),11名患者中有2名获得部分缓解(18%)。达到完全缓解的患者的临床反应是持久的,6名患者中有5名在最后一次就诊时保持持续的完全缓解。部分获得部分缓解的患者的临床反应也是持久的。6名获得完全缓解的患者的中位反应持续时间为181天(范围162-290天。患者(BZ004, BZ024和B025)的顺序CT或PET-CT图像显示持久。CD19-BBz(86) CAR - T细胞输注后持续完全或部分缓解。这些数据表明CD19-BBz(86) CAR - T细胞产生有效和持久的抗肿瘤反应。
根据共识标准对CRS的严重程度进行分级15,24。神经毒性根据美国国家癌症研究所不良事件共同毒性标准(NCI CTCAE;版本4.03)。在25例输注的患者中,没有观察到超过1级的CRS。在任何治疗的患者中,没有观察到神经毒性。没有研究参与者需要药物治疗来缓解轻度副作用(1级CRS)。一名患者(患者BZ010)在入组前对6种化疗药物有难治性病史,对CD19-BBz(86) CAR - T细胞输注无反应,在输注后1个月死于疾病进展。在本试验中,没有患者出现剂量限制性毒性(DLT),也没有达到最大耐受剂量(MTD)。大多数患者出现了细胞毒性淋巴细胞清除化疗预期的毒性,包括骨髓抑制。
综上所述,这些数据表明CD19-BBz(86) CAR - T细胞疗法具有强大的临床疗效,不会引起任何神经毒性或严重的CRS(大于1级)。
CRS的不良事件和神经毒性与快速增殖的CAR - T细胞在遇到CD19肿瘤细胞或正常B细胞后直接产生的血清细胞因子水平显著升高或CAR - T细胞激活的髓细胞间接产生的血清细胞因子水平显著升高密切相关。一组血清炎症和免疫调节细胞因子,趋化因子和T细胞效应蛋白在患者血清中被量化。与之前报道的抗cd19 CAR - T细胞治疗后血清细胞因子浓度显著升高(15,18,19)相反,在所有接受治疗的患者中,在CD19-BBz(86) CAR - T细胞输注后的不同天,血清细胞因子和免疫调节剂,如IL-6、肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ、IL-17A、IL-2、IL-15、IL-5、il - 12p70、IL-1β和c反应蛋白(CRP),出人意料地都保持在基础或低水平(图3a,b)。只有T细胞效应蛋白颗粒酶A和颗粒酶B的血清浓度在完全或部分缓解的患者中高于进展性疾病患者(图3c)。所有患者均观察到正常CD19 B细胞长时间耗损,而CD3 T细胞数量恢复正常。治疗患者观察到低γ -球蛋白血症。其他血液蛋白水平也被检测。总的来说,这些数据表明CD19-BBz(86) CAR - T细胞产生有效的抗肿瘤反应,而不会引起血清细胞因子浓度升高,而血清细胞因子浓度升高是导致CRS和神经毒性的主要原因。
图3 CD19-BBz(86) CAR - T细胞输注后血清细胞因子水平无显著升高
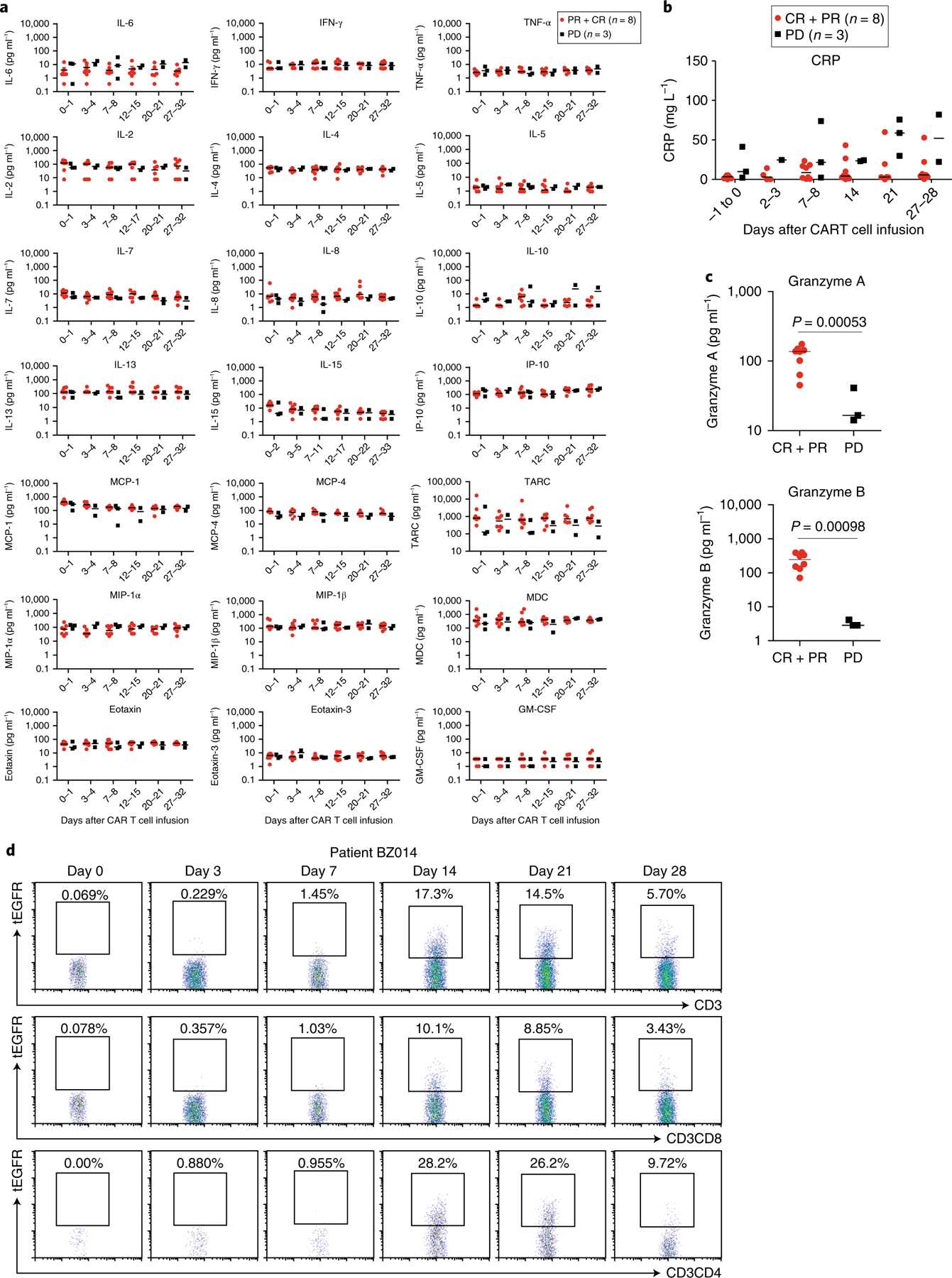
来自6名患者的数据显示,大多数tEGFR CD19-BBz(86) CAR - T细胞在体内扩增后(中位数为95.2%)为CD45RA+ -,并且相当一部分tEGFR CD19-BBz(86) CAR - T细胞表现出CD45RA+ - CCR7中心记忆表型+ 28-30。在细胞输注后317天(患者BZ015),tEGFR CAR - T细胞仍可检测到,45.8%的tEGFRCD3CD8 CD19-BBz(86) CAR - T细胞表现出CD45ROCCR7中枢记忆表型。这些数据表明,在接受治疗的患者中,CD19-BBz(86) CAR - T细胞在体内持续扩增和记忆生成。
本研究结果表明,缺乏内在信号功能的CD8α细胞外铰链和细胞内结构域的长度对CAR - T细胞的细胞因子产生、增殖和记忆产生至关重要。在这项研究过程中,一些临床前研究也表明铰链和跨膜结构域序列在CAR - T细胞活化和功能中的重要作用31,32。该研究为设计具有最佳铰链长度和细胞内序列的CAR提供了一条途径,以提高CAR - T细胞治疗的安全性和有效性。
研究人员意外地发现,在接受治疗的患者中,包括那些完全或部分缓解的患者,在输注CD19-BBz(86) CAR - T细胞后,血清细胞因子浓度没有显著升高。细胞因子是血清中半衰期很短的小分子,在局部淋巴组织或炎症组织中具有一定浓度的功能33,34。本研究中生成的CD19-BBz(86) CAR - T细胞产生细胞因子和细胞增殖的能力低于具有原型CD19-BBz CAR的T细胞,但保留了细胞溶解活性。CD19-BBz(86) CAR - T细胞在体内持续增殖并分化为记忆细胞,这可能有助于持久的反应。T细胞原型CD19-BBz CAR和CD19-BBz(86)变体CAR之间功能差异的机制尚不清楚。影响CD8α铰链和细胞内结构域序列的遗传改变可能会改变CD19-BBz CAR的稳定性和二聚化,以及它与下游接头和T细胞活化信号分子的相互作用。到目前为止,对CARs信号传导如何指导T细胞功能输出的理解仍处于初级阶段35。需要全面的研究来揭示CD19-BBz(86) CAR - T细胞的信号传导和激活的机制特征。此外,需要多中心临床试验来评估这种新的CAR - T细胞疗法的安全性和有效性。
总之,本研究表明,改良版的CD19-BBz(86) CAR - T细胞可有效治疗难治性B细胞淋巴瘤,且不会引起神经毒性或严重的CRS,是一种安全有效的抗cd19 CAR - T细胞疗法。
文章转载自《PubMed Central》
目前免疫管家已开通微信公众号,健康界,知乎,今日头条等多自媒体网站并且同名[免疫管家]
扫描下方二维码,或者直接电话咨询免疫管家医学部(400-880-3716),为癌友患者们分享更多信息。

免责声明:免疫管家为免疫科普平台,文本参考来源于网络,版权归原作者所有。该文章仅供分享,如涉嫌侵犯您的著作权请联系我们删除,谢谢!












