嵌合抗原受体(CAR) t细胞疗法正在成为一种有效的癌症治疗方法,如血液系统恶性肿瘤,但其作为治疗实体肿瘤(如结直肠癌)的有效性仍有待进一步研究。一个发展迅速的领域是鉴定和表征用于CAR设计和评估的新型癌症相关配体受体。众所周知,CD6受体CD166和CD318在结直肠癌中高度表达,一些car - t也在临床前和临床研究中被探索用于治疗结直肠癌,并有良好的安全性和有效性发现。在这里,研究人员构建了一个基于CD6细胞外结构域的CAR,并在靶阳性的人CRC细胞系中证明了它的细胞毒性作用。出乎意料的是,研究人员发现CD6-CAR-T细胞靶向CD166而不是CD318。此外,随着细胞因子IFN-γ的显著释放,CD6-CAR-T细胞对cd166阳性细胞系以剂量依赖的方式表现出强大的细胞毒性。特别是,CD6-CAR-T细胞显示出针对结直肠癌癌症干细胞(CSCs)的强大细胞毒性,这突出表明CD6-CAR-T是治疗结直肠癌的一种有前景的方法。
尽管50岁及以上成年人的筛查率有所提高,平均风险发生率和死亡率同时下降,但结直肠癌(CRC)在年轻患者群体中的发病率正在上升,目前是男性和女性中第三大常见癌症,也是世界上第二大癌症相关死亡原因。在过去的几十年里,传统的治疗选择,如手术、放疗、化疗,以及这些治疗的组合,已经取得了进展;然而,结直肠癌患者的5年生存率仍然很低(不到15%),近40%的结直肠癌患者最终复发并发生晚期转移。显然需要新的治疗方案来提高结直肠癌患者的生存率。
免疫疗法正迅速成为治疗癌症的一种有效的治疗策略。事实上,一些结直肠癌疫苗正在进行临床试验,其中一些取得了令人鼓舞的结果。例如,目前使用痘病毒疫苗方案的临床试验研究报道,大约56%的患者对转移性癌表现出显著的免疫应答。另一种使用单克隆抗体的方法,包括肿瘤靶向单克隆抗体和免疫调节单克隆抗体,也被证明可以有效治疗CRC患者的肿瘤亚型。最近的一项研究报道,错配修复缺陷的局部晚期直肠癌对单药程序性细胞死亡配体1 (PD-1)阻断高度敏感,这种治疗在所有12名受试者中均获得临床完全缓解。此外,中国临床肿瘤学会(2021)建议,对于微卫星不稳定性高/错配修复缺陷(MSI-H/dMMR)患者,无论一线、二线或三线治疗,都推荐PD-1单克隆抗体治疗,这进一步表明了免疫疗法治疗结直肠癌的重要性。
在治疗癌症的各种免疫疗法中,嵌合抗原受体(CAR) t细胞疗法非常有前景,在血液系统恶性肿瘤中取得了巨大成功,但作为CRC的治疗还不太成熟。然而,迄今为止,针对一系列肿瘤相关抗原(TAAs)的临床前研究已经报道了作为结直肠癌潜在治疗方法的有希望的结果,包括靶向癌胚抗原(CEA)、表皮生长因子受体(EGFR)、间皮素(MSLN)、粘蛋白1 (MUC1)、自然杀伤组2成员D (NKG2D)及其配体、人表皮生长因子受体2 (HER2)、环化酶C (GUCY2C)、上皮细胞粘附分子(EpCAM)、肿瘤相关糖蛋白(TAG)-72、c-met和CD133。除了这些临床前研究外,一些临床试验也报道了CAR-T治疗结直肠癌的安全性和有效性数据,但对于某些治疗设计的不良反应仍需谨慎。然而,目前的证据支持CAR-T疗法作为结直肠癌患者潜在的、可行的治疗策略。
研究表明,癌细胞的侵袭性和转移性是由免疫细胞表达CD6调节的,CD6是一种105 kDa至130 kDa的I型跨膜糖蛋白,几乎完全由淋巴细胞(包括大多数成熟T细胞和约50%的自然杀伤(NK)细胞)表达,是一种高度保守的富含半胱氨酸的氨基酸超家族清除率受体。在人类中,CD6是与自身免疫性疾病治疗相关的潜在治疗靶点,而最近的一项研究也表明,抗CD6单克隆抗体UMCD6在NK细胞和CD8+ T细胞上上调活化受体NKG2D的表达,下调抑制受体NK细胞凝集素样受体亚家族C成员1 (NKG2A)的表达,同时增加穿孔素和颗粒酶B的产生。抗cd6单克隆抗体通过对CD4+淋巴细胞分化的影响来控制自身免疫,同时通过对CD8+和NK细胞的不同作用来增强对癌细胞的杀伤,这两种抗体的结合能力为癌症免疫治疗提供了一种抑制而不是增强自身免疫的潜在新途径。有趣的是,已知的活化白细胞粘附分子(ALCAM/CD166)配体CD6是一种存在于细胞表面的免疫球蛋白超家族跨膜糖蛋白,分子量为105 kDa。CD6最近也被报道为含有cub结构域的蛋白1 (CDCP1)的配体,CDCP1是一种I型跨膜蛋白,也被称为CD318。这与CD6的三个细胞外结构域(scsc1、2和3)的观察结果一致,CD6的scsc1结构域与CD318结合,而scsc3结构域与CD166结合。
CD318在肿瘤中的重要性体现在其在乳腺、肺、结直肠、卵巢、肾、肝、胰腺和造血系统等恶性肿瘤中的表达上调。此外,CD318在肿瘤发生以及肿瘤的发展、侵袭和转移中起着关键作用。作为预后标志物,CD318表达也与癌症预后不良相关。此外,也有研究表明,一些表达膜定位CD318的癌组织比细胞质表达CD318的癌组织预后更差。在结直肠癌中,CD318的表达显著上调,CD318高表达的患者总体生存率和无病生存率低于CD318低表达的患者。因此,CD318可能成为治疗结直肠癌的靶点。
另一种CD6相互作用蛋白CD166的过表达与多种癌症有关,包括结直肠癌、乳腺癌、胃癌、肝癌、肺癌、前列腺癌、胰腺癌、黑色素瘤。此外,CD166在一些癌症中被认为是一种假定的癌症干细胞(CSC)标记物,并且在人类CRC和CRC-CSC中也被发现过表达[25]。此外,其表达与癌症预后不良或早期复发有显著正相关。
在这项研究中,研究人员研究了为CD6设计的CAR可能对结直肠癌细胞的致瘤性生长有效的可能性。为此,研究人员设计了三种基于全长CD6细胞外结构域、cd166结合结构域和cd318结合结构域的car。然后,研究人员筛选鉴定了一种新的抗CD166 CAR,其包含抗原识别结构域,该结构域不是scFv,而是天然配体CD6的细胞外结构域,模仿CD6和CD166之间的自然结合,构建第二代CAR (CD6-CAR) T细胞。然后在体外测试这些CD6-CAR-T细胞影响结直肠癌细胞和csc的能力。
为了确定CD6的全长以及特定的细胞外结构域如何与CD166和CD318结合(图1a),研究人员分别设计了三种car (CD6- scrc1 - car、CD6- scrc3 - car和CD6- car) (car的示意图如图1b所示)。同样,研究人员使用CD19-CAR作为阴性对照。为了确定慢病毒载体感染T细胞的能力,通过倒置荧光显微镜观察T细胞表面CAR的表达(supplementary .1-图1)。S1),流式细胞术检测mKATE2(图1c和d)。如图1、图1c和图d所示,结果证实所有CAR都具有高水平的传染性,CAR表达频率量化为45%或更高。
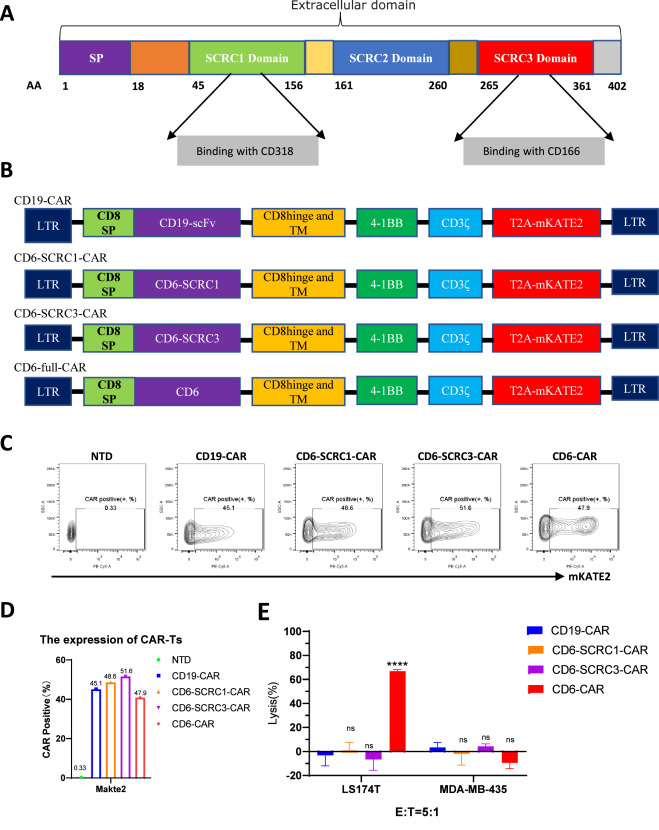
为了确定CARs是否对培养细胞有毒性作用,研究人员使用以下细胞系进行了细胞毒性试验:LS174T(目标阳性)和MDA-MB-435(目标阴性)。如图1e所示,与CD166-和cd318阳性细胞中的CD19-CAR细胞相比,将LS174T细胞暴露于CD6-CAR-T细胞中,发生靶向特异性裂解的细胞比例明显更高(LS174T,图2a)。相反,MDA-MB-435细胞的细胞裂解没有显著增加,如CD166和cd318阴性细胞组所示(MDA-MB-435,图2a)。
文章转载自《Elsevier》
目前免疫管家已开通微信公众号,健康界,知乎,今日头条等多自媒体网站并且同名[免疫管家]
扫描下方二维码,或者直接电话咨询免疫管家医学部(400-880-3716),为癌友患者们分享更多信息。

免责声明:免疫管家为免疫科普平台,文本参考来源于网络,版权归原作者所有。该文章仅供分享,如涉嫌侵犯您的著作权请联系我们删除,谢谢!
相关推荐
随便看看
- 胶质母细胞瘤的CAR-T 细胞疗法
- 靶向CAR-T疗法的新型GUCY2C:在晚期结直肠癌中的疗效。
- 一种安全有效的抗CD19 CAR T细胞疗法
- CAR-T细胞在实体瘤中的应用:挑战与机遇
- CAR-T细胞疗法治疗乳腺癌:从基础研究到临床应用
- CD19 CAR-T 细胞治疗 B 细胞恶性肿瘤:系统评价和荟萃分析,重点关注 CAR 结构域、制造条件、细胞产物、剂量、患者年龄和肿瘤类型的临床影响
- CAR-T细胞疗法将患有快速进展的狼疮性肾炎的青少年从血液透析中拯救出来
- CAR-T细胞联合mRNA疫苗治疗实体瘤
- HER2特异性嵌合抗原受体-T细胞靶向治疗转移性结直肠癌
- 评估工程化CAR - T细胞on开关的可逆控制。











