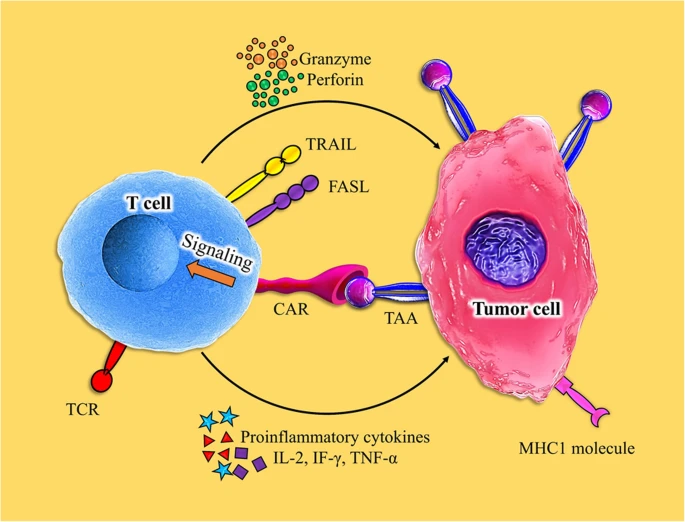
嵌合抗原受体(CAR) T细胞疗法是一种有吸引力的细胞免疫治疗策略,可以利用T细胞的独特特性来治疗癌症。
CAR是细胞表面抗原的重组受体,可改变血液T淋巴细胞和其他类型免疫细胞的特异性和活性。肿瘤靶向T细胞的快速建立、障碍的消除和主动免疫的增强动力学被认为是CAR - T细胞在癌症中应用的一般原则。car修饰的T细胞作为“活药物”获得了超生理属性和性能,在T细胞中表达后不仅可以显示出即时效果,还可以显示出长期效果。对于T细胞中的CAR工程,细胞必须经过培养才能用于转导和扩增。在这一过程中,转导可以利用多种途径,但既定的基因转移是必须的,以使CAR在克隆扩增和持续的T细胞中持续表达。考虑到这些原理,在细胞表面表达的抗原可以被CAR靶向,各种T细胞亚群、T细胞祖细胞和其他免疫细胞,特别是自然杀伤(NK)细胞可以被CAR靶向。重要的是,具有显著潜能和信号质量的car可以调节T细胞的扩增和坚持,以及在癌症微环境中工程T细胞激活的强度,这些特性强烈地改变了癌症靶向T细胞的功效和安全性。基于生物学和分子研究,CAR递送比转导T细胞受体(TCRs)具有更广泛的功能效应,其中TCRs对靶抗原的亲和力通常会改变信号传导能力,这是决定T细胞命运的核心因素。总的来说,基于嵌合抗原受体构建的模块化性质,car正在迅速发展,并在广泛的免疫治疗中显示出显著的有效应用能力。
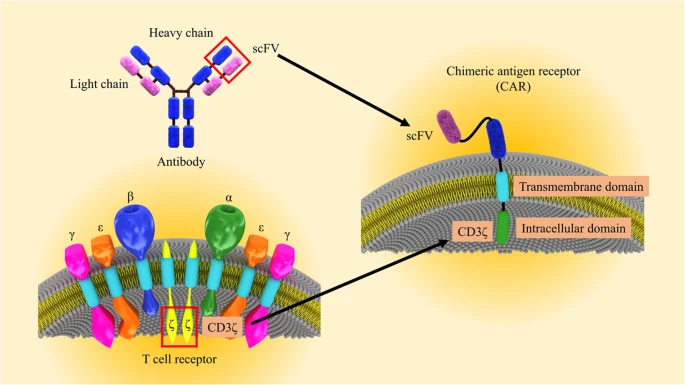
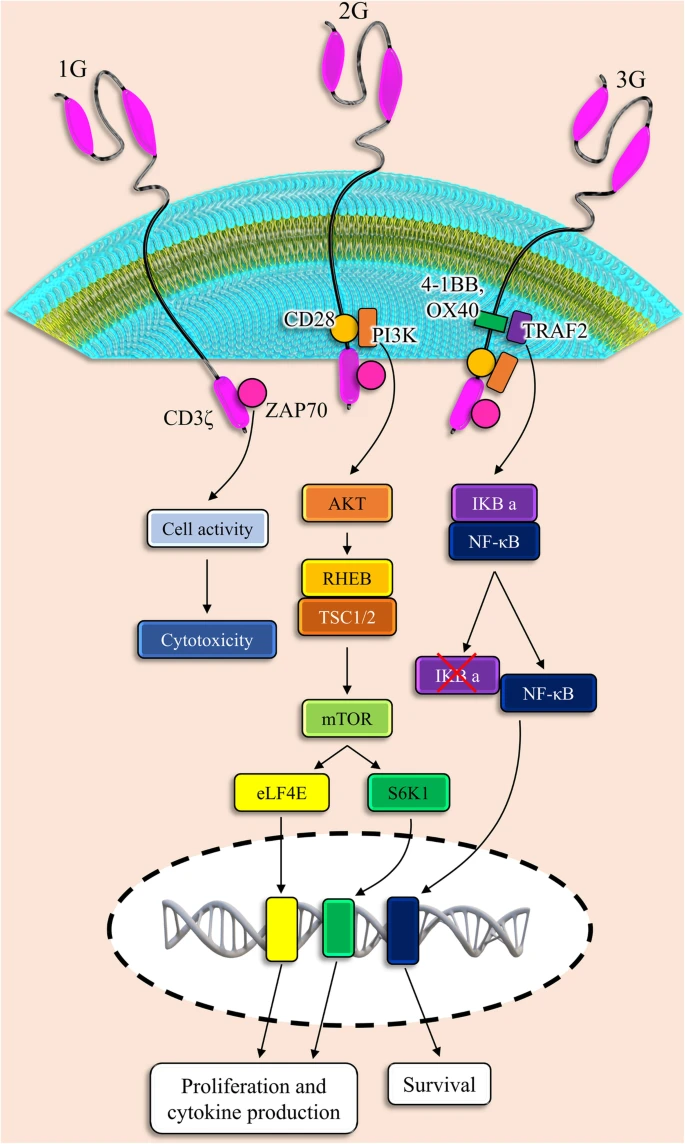
CAR包含一个细胞外抗原识别结构域,该结构域由识别癌细胞细胞膜上特定蛋白质的单克隆抗体片段(例如,实体瘤细胞上的EGFR或B细胞上的CD19)和一个细胞内刺激结构域构建,该结构域提供t细胞受体(TCR)信号以触发CAR - t细胞的激活和功能。第一代CAR - T细胞含有来自TCR CD3 ζ链的胞内结构域,可诱导T细胞对靶向癌细胞产生细胞毒性作用,但在回输后不能促进CAR - T细胞在体内扩增;另一方面,第二代和第三代CAR - T细胞含有额外的共刺激细胞内结构域,这反过来增强了CAR - T细胞生长、扩张并最终在患者体内持续存在的潜力。
鉴于有许多方法可以使肿瘤抑制T细胞,可以在临床试验的细胞工程和联合疗法的数量是无限的。研究评估了最近在实体瘤CAR- T治疗方面的研究,并简要讨论了它们的疗效和重要的靶向表面标志物。
卵巢癌
由于卵巢癌在手术和多药化疗后的复发率很高,迫切需要新的治疗方法。肿瘤相关糖蛋白72 (TAG72)在卵巢癌表面的高表达率已被用作CAR-T细胞治疗的靶点。据报道,人源化的tag72特异性CAR - T细胞在OC中显示出细胞毒性和细胞因子的产生;另一方面,基于tag72的CAR - T细胞显著降低了增殖潜力,增强了实验小鼠的生存能力[55]。其他体外研究表明,muc16特异性CAR - T细胞在OC细胞中具有强大的抗肿瘤功能。在小鼠模型中发现静脉或腹腔注射MUC16-CAR-T细胞可完全延缓卵巢癌进展或根除恶性细胞。研究也证实了MUC16作为卵巢癌细胞治疗的潜在靶点的研究重要性。另一方面,有研究表明,Her2-CAR-T细胞能够抑制表达Her-2/neu的人卵巢SKOV3细胞系的生长潜能,使用Meso-CAR-T细胞可以抑制增殖,提高小鼠的生存能力。此外,5t4特异性CAR - T细胞和fr α特异性CAR - T细胞对卵巢癌细胞的生长和进展具有显著的抑制作用。在最近的一项研究中,CD19-和间皮素(MSLN)- car NK-92细胞被设计为靶向CD19和MSN。慢病毒基因转染后NK-92细胞表面CD19-和MSLN-CAR分子的表达均显著增加。MSLN- car NK细胞在体外显著杀伤MSLN卵巢癌细胞,包括SK-OV-3和OVCAR-3。
乳腺癌
研究人员发现,在三阴性乳腺癌(TNBC)细胞上识别tMUC1后,CAR - T细胞MUC28z(一种含有CD28和CD3ζ结构域的特异性嵌合抗原受体)可扩增Th1分泌的颗粒酶B、IFN-γ和其他类型的细胞因子和趋化因子的合成。在这项研究中,在异种移植模型中,单剂量MUC28z CAR - T细胞显著降低TNBC肿瘤的增殖和存活。其他研究表明,CD27或4-1BB共刺激、自我富集的NKG2D car -重定向T细胞参与TNBC肿瘤的抗癌功能。其他研究表明,基于hrg1 β的CAR-T细胞通过HER家族受体成功抑制乳腺癌的增殖,并能够提供一种有吸引力的治疗方法,以击败癌症对基于her2的靶向治疗的耐药性。与此同时,Munisvaradass等人发现人类抗HER2 CAR - T细胞在HER2过表达的乳腺癌细胞中表现出理想的靶向性,并引发细胞死亡[63]。此外,特殊CAR - T细胞识别间皮素已被描述为乳腺癌治疗的一个有前途的免疫治疗目标。
前列腺癌
前列腺干细胞抗原(PSCA)和前列腺特异性膜抗原(PSMA)通常用于靶向嵌合抗原受体,以达到前列腺癌(PC)的适当治疗效果。抗PSMA的CAR - T细胞对人PC细胞表现出很强的杀伤能力,在PC细胞中表现出很强的扩增能力和细胞毒性潜力。
肾癌
根据报道,在各种类型的肾癌中表达的羧基酸酐酶ix (CA-IX)已被发现是CAR - T细胞治疗的新靶点。CA-IX是一种金属蛋白酶,通常参与催化二氧化碳水合作用,而在肾细胞癌和胃黏膜上皮、小肠上皮、十二指肠等几种正常组织中,CA-IX是一种关键抗原,胆道树中表达量适中。此外,缺氧条件可导致CA-IX在大范围的组织中表达。研究发现,第一代cax - car - T细胞对肾癌细胞参与高水平的细胞因子分泌,并具有细胞毒功能。
胃癌
最近的研究表明,双特异性的Trop2/PD-L1 CAR-T细胞通过瘤内注射可以显著抑制胃癌的生长,其抑制作用比特异性的Trop2 CAR-T细胞更为突出。这些发现揭示了新型双特异性Trop2/PD-L1 CAR-T细胞参与了胃癌的Trop2/PD-L1和检查点阻断,从而促进了CAR-T细胞对胃癌和其他类型实体瘤的细胞毒性作用。此外,有研究证实,注射含有间皮素scFv、CD3ζ、CD28和DAP10胞内信号域(M28z10)的间皮素car - T细胞可触发胃癌细胞死亡,并显著抑制肿瘤生长。根据其他研究,使用claudin18.2-CAR - T细胞[74]、NKG2D-CAR - T细胞、叶酸受体1 (FOLR1)-CAR - T细胞、HER2-CAR - T细胞可以被认为是胃癌治疗的一种新的治疗途径。在最近的一项研究中,研究人员还发现,ICAM-1 CAR - T细胞单独或联合化疗药物紫杉醇或CAR - T细胞修饰IL-12的释放是一种很有前景的方法,可以大大改善ICAM-1高晚期胃癌患者的病情。
胰腺癌
研究证实,在胰腺癌中,表达cxcr2的CAR - T细胞向IL-8和含有IL-8的微环境转移的能力更强。因此,表达cxcr2的CAR - T细胞对已识别的表达αvβ6的胰腺肿瘤异种移植物具有更强的抗肿瘤活性。此外,B7-H3。CAR-T细胞在体外和原位以及转移性异种移植小鼠模型中治疗胰腺导管腺癌的有效性已经得到证实。有趣的是,4-1BB共刺激在生成的T细胞中支持较低的PD-1表达,当我们想要靶向PD-L1组成性表达的肿瘤细胞时,支持更强的抗肿瘤活性。
肺癌
受体酪氨酸激酶样孤儿受体1特异性(ROR1)-CAR - T细胞治疗在人肺癌A549细胞系中支持强抗肿瘤活性。重要的是,ROR1-CAR - T细胞浸润到癌组织中并根除多层肿瘤细胞。同样,EGFRvIII-CART特异性地、熟练地识别并杀死表达和释放穿孔素、颗粒酶B、IFN-γ和TNF-α等细胞因子的A549-EGFRvIII细胞;另一方面,有研究表明,EGFRvIII-CART细胞可显著减少小鼠体内A549-EGFRvIII细胞的转移,显著延长小鼠的生存期,且无任何副作用。此外,已经证实基于CAR - T细胞的间皮素、产生红细胞生成素的肝细胞癌A2 (EphA2)、PSCA和mucin-1可以导致肺癌的预期治疗结果。最近,一组研究人员提出,在非小细胞肺癌(NSCLC)中使用PD-L1- car - T,可能对PD-L1高和EGFRmut非小细胞肺癌表现出抗肿瘤细胞毒活性,并在一定程度上导致(PD-L1)非小细胞肺癌患者的康复。另一方面,Chen及其同事介绍了delta-样3 (DLL3)作为治疗小细胞肺癌(SCLC)的一个有吸引力的靶点。他们发现,抗体和CAR-T细胞单独靶向DLL3或与PD-1抑制一起杀死DLL3肿瘤细胞,包括H82、H196和H446细胞系。
肝癌
CAR-T疗法用于肝癌治疗的研究才刚刚开始,还需要更多的研究。然而,基于CAR-T细胞的CEA、glypican-3、mucin-1、上皮细胞粘附分子和癌胚抗原在肝癌治疗中的效力已被证实。Glypican-3 (GPC3)抗体联合CAR - T治疗可能是治疗肝脏恶性肿瘤的有效方法。Liu等研究表明,使用32A9单克隆抗体/CAR - T细胞在体外杀死(GPC3) HCC细胞,并在体内使异种肝移植肿瘤消退。另一项研究表明,表达il - 15/21的GPC3/CAR - T细胞可促进T细胞对HCC的抗肿瘤反应。
结肠直肠癌
根据研究结果,嵌合抗原受体T细胞疗法可能是治疗结直肠癌的有效方法。总的来说,在结直肠癌中,NKG2D、CD133、GUCY2C(鸟苷酸环化酶2C)和TAG-72是达到有希望的治疗目标的最重要的靶抗原。Humbach等人研究发现,通过改变肿瘤环境中Th2至Th1/17执行谱的炎症作用,释放IL-7/12细胞因子的间充质干细胞(mesenchymal stem cells, MSCs)可提高CAR - T细胞对结直肠癌细胞的抗肿瘤活性。根据先前的证据,人类结直肠肿瘤中双皮质素样激酶1 (DCLK1)表达水平升高与较高的死亡率相关。最近的一份报告显示,DCLK1的靶向CAR-T疗法可以有效地根除原发性和转移性结肠癌细胞。
总而言之,CAR - T细胞疗法的发展是晚期恶性肿瘤,特别是血液疾病患者的一种有希望的治疗选择。CAR - T细胞的进展反映了不同科学领域的观念融合。
文章转载自《BMC》
目前免疫管家已开通微信公众号,健康界,知乎,今日头条等多自媒体网站并且同名[免疫管家]
扫描下方二维码,或者直接电话咨询免疫管家医学部(400-880-3716),为癌友患者们分享更多信息。

免责声明:免疫管家为免疫科普平台,文本参考来源于网络,版权归原作者所有。该文章仅供分享,如涉嫌侵犯您的著作权请联系我们删除,谢谢!











