相关推荐

Cantargia 宣布 Nadunolimab 治疗晚期三阴性乳腺癌 (TNBC) 的 2 期 TRIFOUR 试验的初步顶线疗效结果
7月17日,Cantargia公司宣布 Nadunolimab 治疗晚期三阴性乳腺癌(TNBC)的 2 期 TRIFOUR 试验的初步顶线疗效结果。
免疫管家 2025-07-21

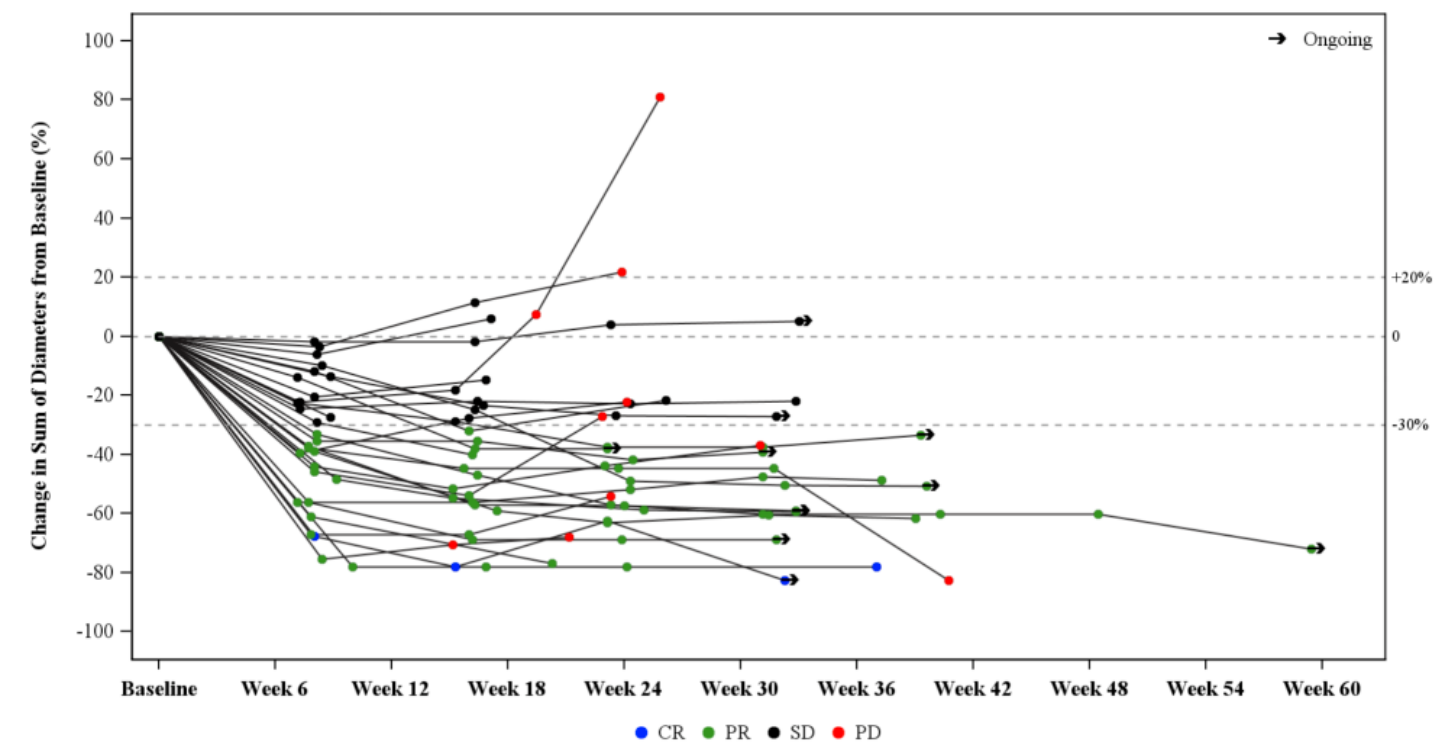
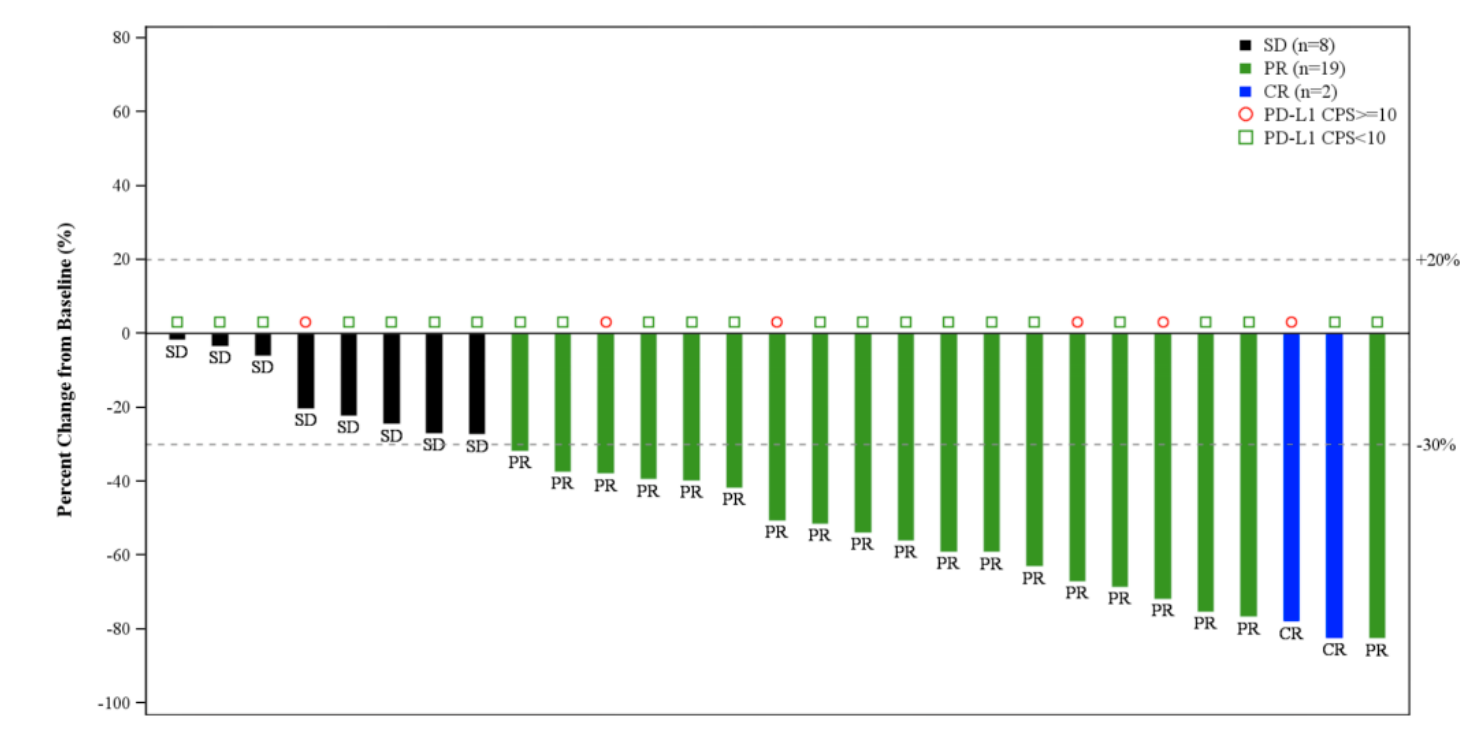
ROR1特异性CAR-T细胞治疗晚期造血系统及上皮性恶性肿瘤的I期临床试验公布
2025年2月3日,《CLINICAL CANCER RESEARCH》发表了题为:Phase I Study of ROR1-Specific CAR-T Cells in Advanced Hematopoietic and Epithelial Malignancies的研究论文,报告了ROR1特异性CAR-T细...
免疫管家 2025-06-18
创新药物接连获批,肺癌精准治疗迎来突破性进展
肺癌是全球癌症相关死亡的主要原因,严重威胁着我国居民的生命健康。根据组织病理学特点不同,肺癌可分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),非小细胞肺癌(NSCLC)是最常见的肺癌类型,占所有肺癌病例的约85%。近日,国家药监局批准多款肺癌药物新适应症,标志着我国在肺癌治疗领域取得重要进展。
免疫管家 2025-04-28

依沃西单抗第二项肺癌适应症获批
2025年4月25日,康方生物宣布其独立自主研发的全球首创PD-1/VEGF双特异性抗体新药依达方®(通用名:依沃西单抗注射液)单药用于PD-L1阳性(TPS≥1%)的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌(NSCLC)的一线治疗的新药上市申请(sNDA)...
免疫管家 2025-04-27