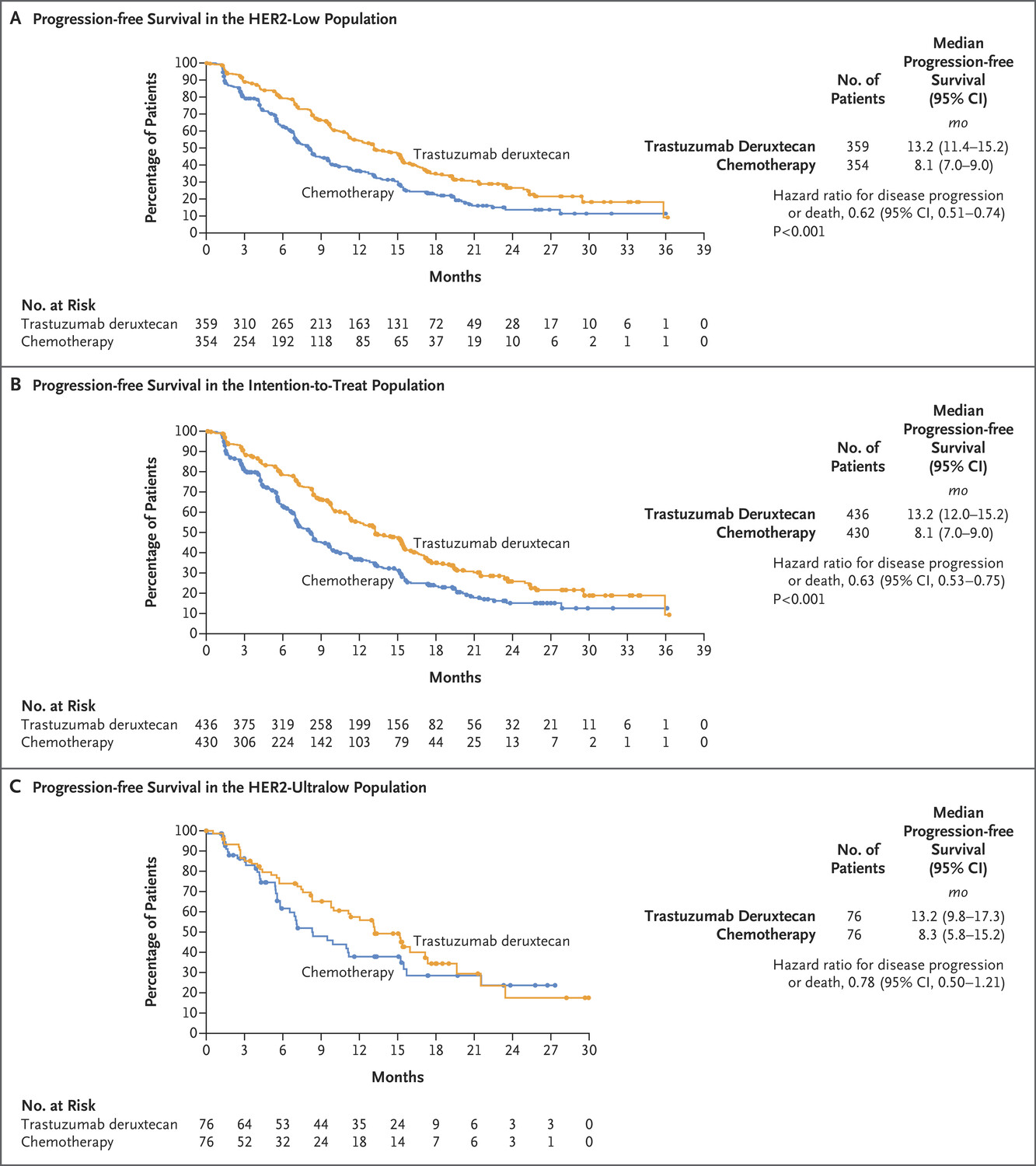
奥英妥珠单抗(Besponsa、Inotuzumab ozogamicin、奥加伊妥珠单抗)
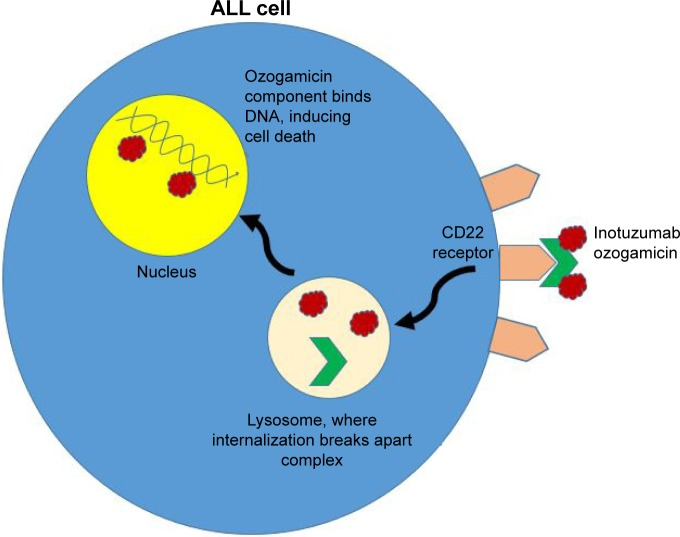
奥英妥珠单抗(inotuzumab ozogamicin)是靶向CD22抗体-药物偶联物(ADC)药物。Inotuzumab由抗CD22的人源IgG4 MoAb(单克隆抗体)组成,而ozogamicin则来自calicheamicins, 这是一类有效的抗肿瘤抗生素,可靶向小凹槽中的DNA并诱导链断裂。
在化合物的抗体部分与白血病细胞表面的CD22受体结合后,整个inotuzumab - calicheamicin偶联物进入细胞,内化后,抗体-药物偶联物通过内体和溶酶体运输,酸性环境将inotuzumab从无活性的ozogamicin中水解出来。后一种成分随后被细胞内谷胱甘肽激活并进入细胞核,在那里它诱导细胞周期阻滞和细胞凋亡或细胞死亡。
2017年08月17日,奥英妥珠单抗(Besponsa、Inotuzumab ozogamicin、奥加伊妥珠单抗)获美国食品药品监督管理局(FDA)批准,适用于成人复发或难治性前B细胞急性淋巴细胞性白血病。在III期研究中,326名患者入组,基于最初选择用于主要分析的218名患者的数据获得批准。在这些患者中,inotuzumab ozogamicin的完全缓解(CR)率为35.8%,而化疗为17.4%。在达到CR的患者中,使用inotuzumab ozogamicin治疗的患者中有89.7%的微小残留病灶(MRD)为阴性,而化疗组为31.6%。
2021年12月22日,辉瑞公司宣布,中国国家药品监督管理局已批准贝博萨(注射用奥加伊妥珠单抗)用于复发性或难治性前体B细胞急性淋巴细胞性白血病(R/R B-ALL)成年患者,这也是全球首个经批准治疗R/R B-ALL的抗体偶联药物(antibody-drug conjugate, ADC)。
2024年3月6日,美国食品药品监督管理局(FDA)批准inotuzumab ozogamicin(奥英妥珠单抗,奥加伊妥珠单抗 贝博萨)用于1岁及以上复发或难治性CD22阳性B细胞前体急性淋巴细胞白血病(ALL)的儿科患者。

在一项多中心、单臂、开放标签的研究中,对53名1岁及以上的复发或难治性CD22阳性B细胞前体ALL患儿进行了疗效评估。评估了两种剂量水平—12例患者的初始剂量为1.4 mg/m2/周期,41例患者的初始剂量为1.8 mg/m2/周期。在所有患者中,22例患者实现了完全缓解(CR), 完全缓解率(CR)为42%,CR的中位持续时间为8.2个月。CR患者的(微小残留病灶)MRD阴性率为95.5%。
简要说明书 | |
药物名称 | 奥英妥珠单抗(Besponsa、Inotuzumab ozogamicin、奥加伊妥珠单抗) |
规格剂量 | 1.0 mg/瓶 |
适应症 | 用于复发性或难治性前体B细胞急性淋巴细胞性白血病(R/R B-ALL)成年患者 用于1岁及以上复发或难治性CD22阳性B细胞前体急性淋巴细胞白血病(ALL)的儿科患者 |
参考用量 | 第一周期:0.8mg/㎡第1天,0.5mg/㎡第8、15天,21天为一个周期; 后续周期:患者达到缓解:0.5mg/㎡第1、8、15天,28天为一个周期;患者未达到缓解:0.8mg/㎡第1天,0.5mg/㎡第8、15天,28天为一个周期。 |
不良反应 | 最常见的不良反应为:血小板降低、白细胞减少、中性粒细胞减少、感染、贫血、疲乏、出血、发热、呕吐、头痛、发热性嗜中性球减少症、肝损伤(转氨酶或γ-谷氨酰转移酶升高)、腹痛及高胆红素血症、QT间期延长等 |

相关推荐
随便看看
- 阿伐替尼,阿泊替尼,阿维普替尼 泰吉华Avapritinib
- Ceritinib 色瑞替尼/塞瑞替尼(Zykadia,赞可达)
- 第四代EGFR抑制剂:BI-4020
- 尼莫司汀(Nimustine Hydrochloride for Injection,宁得朗)
- Abemaciclib 玻玛西林,玻玛西尼,阿贝西利 唯择 Verzenio
- BTK抑制剂阿可替尼新适应症申请获受理
- 持续缓解时间长达43.4个月!FAP-IL2v研究数据公布
- EGFR突变非小细胞肺癌新进展,疾病控制率高达100%!
- 阿达格拉西布,KRAZATI(Adagrasib)
- 氟维司群 芙仕得 Fulvestrant(Faslodex)