相关推荐

靶向Claudin18.2的CAR-T细胞产品舒瑞基奥仑赛注射液(CT041)用于胃/食管胃结合部腺癌患者试验最新数据公布
5月31日,《柳叶刀》发表了科济药业研发的一款靶向Claudin18.2蛋白的自体CAR-T细胞治疗候选产品-舒瑞基奥仑赛注射液(CT041)针对Claudin18.2阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌患者的II期临床试验(CT041-ST-01, NCT04581473)的研究结果。这是全球首个针对实体...
免疫管家 2025-06-04
胃癌患者生存期延长!CAR-T疗法最新数据震撼发布,已有患者肿瘤显著缩小!
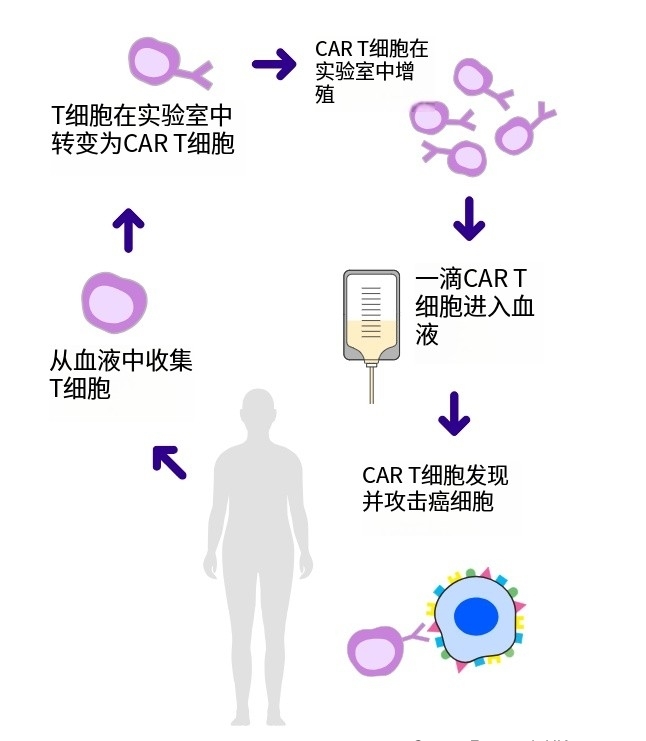
CAR-T疗法,即嵌合抗原受体T细胞疗法,它的工作原理是将你的T细胞转变为更高效的抗癌“机器”。在CAR-T细胞疗法中,医护人员会将一个新基因引入你的T细胞,从而改变这些细胞,使它们能够更有效地检测和杀死癌细胞。简单来说,就是从患者自身的血液中提取T细胞,然后在实验室中对这些T细胞进行基因改造,给它们装上一种特殊的“导...
免疫管家 2025-06-04

自分泌PD-1纳米抗体装甲化双靶向闪CAR-T产品BZE2203在卵巢癌疗效显著
美国癌症研究协会(AACR)年会是全球肿瘤学领域的顶级盛会,近日,2025年第116届AACR年会在美国芝加哥举行。此次会议上,由上海细胞治疗集团联合上海大学附属孟超肿瘤医院及美国子公司Chantibody(CHANTIBODY THERAPEUTICS INC.)共同开展的一项治疗实体肿瘤的自分泌抗PD-1纳米抗体装...
免疫管家 2025-05-15

54岁卵巢癌患者绝处逢生!CAR-T产品BZE2203在卵巢癌战场创造奇迹
卵巢癌是常见的妇科恶性肿瘤之一,这个看似陌生却又悄然威胁着无数女性生命健康的“沉默杀手”,它的发病率在女性生殖系统肿瘤中位居前列,且死亡率长期居高不下,堪称女性健康的重大隐患。2022年,全球约诊断出32.5万例卵巢癌新发病例,约有20.7万例卵巢癌患者死亡。
免疫管家 2025-05-14

BCMA CAR-T产品CT0596初步临床数据公布
近日,科济药业公布了CAR-T细胞产品CT0596的初步临床数据。CT0596为科济药业基于THANK-u Plus™平台开发的一款靶向BCMA的通用型CAR-T细胞注射液,目前正在复发/难治性多发性骨髓瘤(R/R MM)或复发/难治性浆细胞白血病(R/R PCL)中开展一项早期探索性临床研究,用于评估CT0596的安...
免疫管家 2025-05-12

2025 AACR年会:ADC药物引领肿瘤治疗新突破,多款数据惊艳亮相
美国癌症研究协会(AACR)年会是全球肿瘤学领域的顶级盛会,近日,2025年第116届AACR年会在美国芝加哥举行。此次会议上多款靶向不同癌种的ADC药物公布了令人振奋的临床试验数据。
免疫管家 2025-05-06

邦耀生物异体通用型CAR-T产品BRL-301新适应症IND获批
2025年4月17日,上海邦耀生物宣布,其基于具有自主知识产权的通用型细胞平台(TyUCell®)开发的新一代异体CAR-T产品“靶向CD19基因修饰的异体嵌合抗原受体T细胞注射液”(管线代号:BRL-301)针对“复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)”的新适应症临床试验申请(IND),于今日正式获得...
免疫管家 2025-04-17
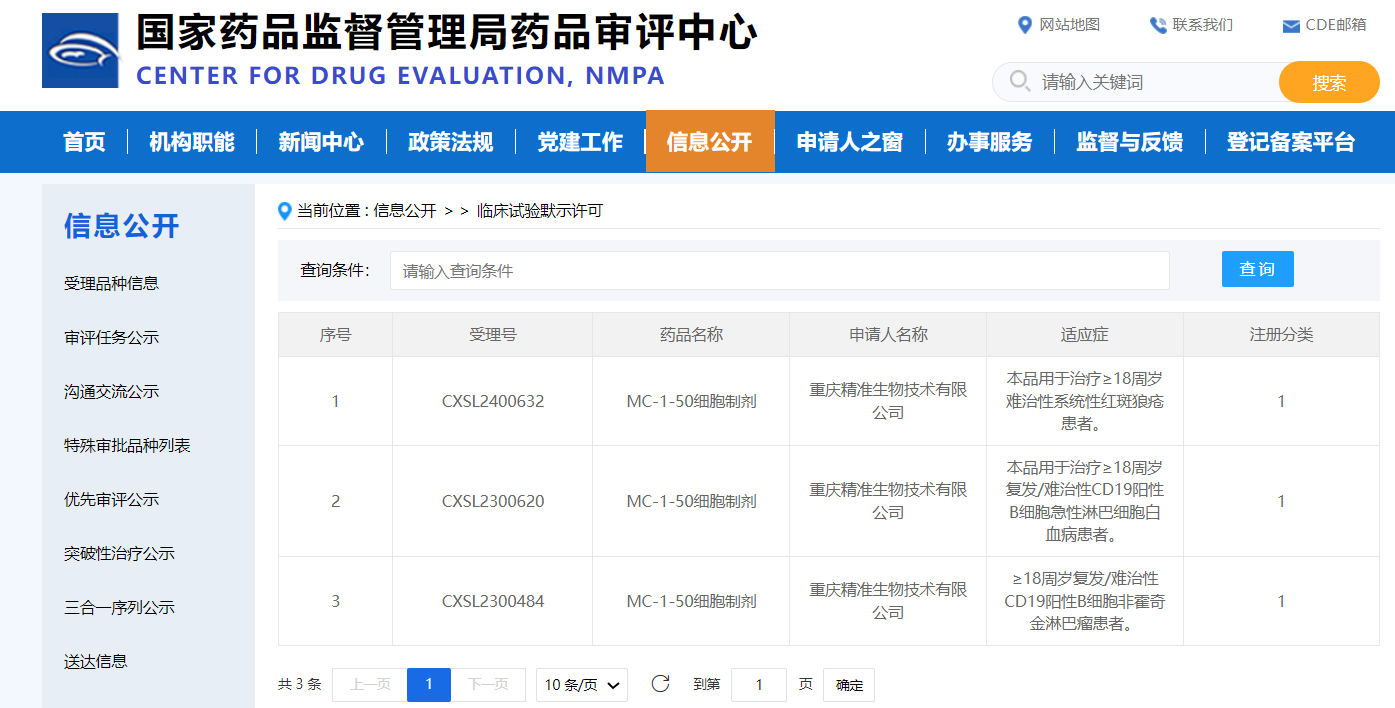
精准生物首款自身免疫疾病CAR-T产品获批临床,用于治疗系统性红斑狼疮
2024年12月6日,精准生物自主研发的MC-1-50细胞制剂获国家药品监督管理局审评中心(CDE)默示许可开展临床试验,用于治疗≥18周岁难治性系统性红斑狼疮。
免疫管家 2024-12-10

热门靶点Claudin18.2迎关注 | 一文简单了解靶向CLDN18.2的胃癌药物进展
Claudin18.2(CLDN18.2)是一种紧密连接分子,主要存在于非恶性胃上皮中,在恶性转化过程中可以在肿瘤细胞表面接近,可以参与肿瘤细胞的增殖、分化和迁移,在各种实体瘤患者中得到了广泛的研究,尤其是在胃肠道癌症患者中,为癌症治疗提供了一个有吸引力的靶点。
免疫管家 2024-12-04

优卡迪CAR-T产品U16注射液长期随访临床数据即将亮相2024年ASH年会
11月6日,优卡迪宣布其自主知识产权产品U16注射液治疗利妥昔单抗难治/复发性B细胞非霍奇金淋巴瘤患者的长期随访临床数据将于第66届美国血液学会(“ASH”)年会上进行展示。
免疫管家 2024-11-07















