相关推荐
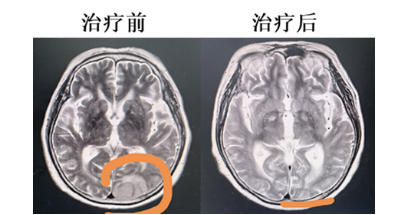
乘典生物的PD-1Ab21-CAR-T治疗晚期B细胞恶性肿瘤取得良好疗效
乘典生物医药研发的新型高效“PD-1Ab21-CD19CAR-T细胞”输入体内后,除了发挥正常CAR-T细胞杀伤肿瘤细胞的功能外,还分泌PD-1抗体与白细胞介素融合蛋白(PD-1Ab21),该融合蛋白可阻断CAR-T上的PD-1抑制信号,并将细胞因子靶向CAR-T细胞,促进CAR-T细胞的增殖,可显著增强CAR-T细胞...
免疫管家 2024-12-23

重磅!新一代CAR-T疗法剑指白血病,白血病患者迎来“生命之光”?
11月8日,美国食品药品监督管理局(FDA)批准新一代CAR-T细胞疗法obecabtagene autoleucel(Aucatzyl,obe-cel)用于治疗复发或难治性B细胞急性淋巴细胞白血病(ALL)成人患者。Aucatzyl是Autolus Therapeutics研发的靶向CD19的CAR-T细胞疗法,据介...
免疫管家 2024-11-12














