相关推荐

癌症也能“打疫苗”对付了?肺癌、肝癌、食管癌、胰腺癌……治疗性癌症疫苗多点开花
2024年,来自苏格兰的Jennifer Robertson发现食物总在食道里“往上走”,伴随着恼人的胃酸反流。就医检查的结果是胃食管癌。 这种被称为“隐形疾病”的癌症,早期难以察觉。确诊时,她的肿瘤已经进展。面对困境,她做出了一个不平凡的决定,加入一项全新的全球试验。 这不是传统意义上预防疾病的疫苗。它专...
免疫管家 2026-02-25

安尼妥单抗(KN026)针对HER2阳性胃癌/胃食管结合部腺癌患者的Ⅲ期临床研究结果公布
近日,肿瘤学领域顶级期刊《肿瘤学年鉴》发表了安尼妥单抗(KN026)针对HER2阳性胃癌/胃食管结合部腺癌患者的Ⅲ期临床研究结果。
免疫管家 2026-01-27
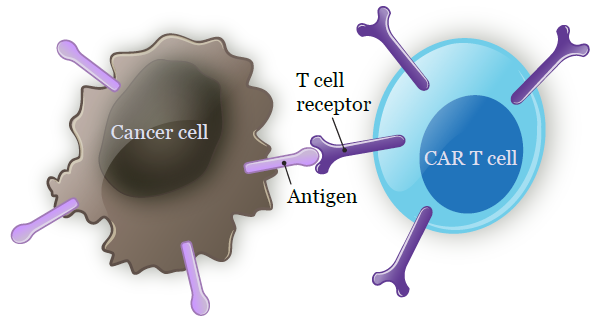
CAR-T攻坚实体瘤疗效获证实!国产CAR-T疗法疾病控制率超90%,肠癌、脑瘤等领域也取得突破
近日,在美国旧金山举办的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCOGI)上,来自中国生物技术公司的研究数据引起了广泛关注:易慕峰生物自主研发的靶向Claudin18.2(CLDN18.2)的CAR-T细胞疗法IMC002,在晚期胃癌/胃食管结合部癌患者中展现出了令人鼓舞的疗效。
免疫管家 2026-01-15

胃癌患者新希望:权威认可!ADC药物维迪西妥单抗联合疗法纳入突破性治疗,疗效数据显著提升
近日,国家药品监督管理局药品审评中心(CDE)显示:维迪西妥单抗纳入突破性治疗,适应症为联合曲妥珠单抗及特瑞普利单抗一线治疗HER2高表达的晚期胃/胃食管结合部腺癌。
免疫管家 2026-01-12

维迪西妥单抗纳入突破性治疗
近日,国家药品监督管理局药品审评中心(CDE)显示:维迪西妥单抗纳入突破性治疗,适应症为联合曲妥珠单抗及特瑞普利单抗一线治疗HER2高表达的晚期胃/胃食管结合部腺癌。
免疫管家 2026-01-09

瑞拉芙普α注射液(商品名:艾泽利)获得NMPA批准上市
1月7日,国家药品监督管理局(NMPA)批准盛迪亚生物医药有限公司申报的瑞拉芙普α注射液(商品名:艾泽利)上市,该品种联合氟尿嘧啶类和铂类药物用于经充分验证的检测评估PD-L1阳性(CPS≥1)的局部晚期不可切除、复发或转移性胃及胃食管结合部腺癌的一线治疗。
免疫管家 2026-01-08

泽尼达妥单抗联合化疗在HER2阳性晚期胃食管腺癌中HERIZON-GEA-01研究数据公布
1月8日,百济神州宣布3期临床研究HERIZON-GEA-01的完整数据。该研究评估了在联合化疗的基础上,HER2靶向双特异性抗体百赫安®(泽尼达妥单抗)单药或再联合PD-1抑制剂百泽安®(替雷利珠单抗)作为HER2阳性(HER2+)局部晚期或转移性胃食管腺癌(GEA)一线治疗的潜力。
免疫管家 2026-01-08

注射用SHR-A1904纳入突破性治疗品种
近日,国家药品监督管理局药品审评中心显示:注射用SHR-A1904单药用于既往接受至少一线系统治疗的CLDN18.2阳性的局部晚期或转移性胃或胃食管交界处腺癌纳入突破性治疗品种。
免疫管家 2025-12-25

无癌生存超5年!中国创新CAR-T疗法交出惊人答卷,实现高达100%的缓解率
CAR-T细胞疗法于2017年首获美国食品药品监督管理局批准,通过调动人体免疫系统对抗癌症。该疗法为那些历经多次治疗失败、希望日渐渺茫的重症患者带来了快速好转,甚至实现长期疗效。
免疫管家 2025-12-17

CAR-T产品IMC002获FDA再生医学先进疗法认定
12月16日,易慕峰生物宣布其自主研发的靶向Claudin18.2(CLDN18.2)的自体CAR-T细胞治疗产品IMC002,已获得美国食品药品监督管理局(FDA)授予的“再生医学先进疗法”认定,该认定基于FDA确认,IMC002用于治疗CLDN18.2阳性、不可切除的局部晚期或复发性/转移性胃癌/胃食管结合部癌,且...
免疫管家 2025-12-16















