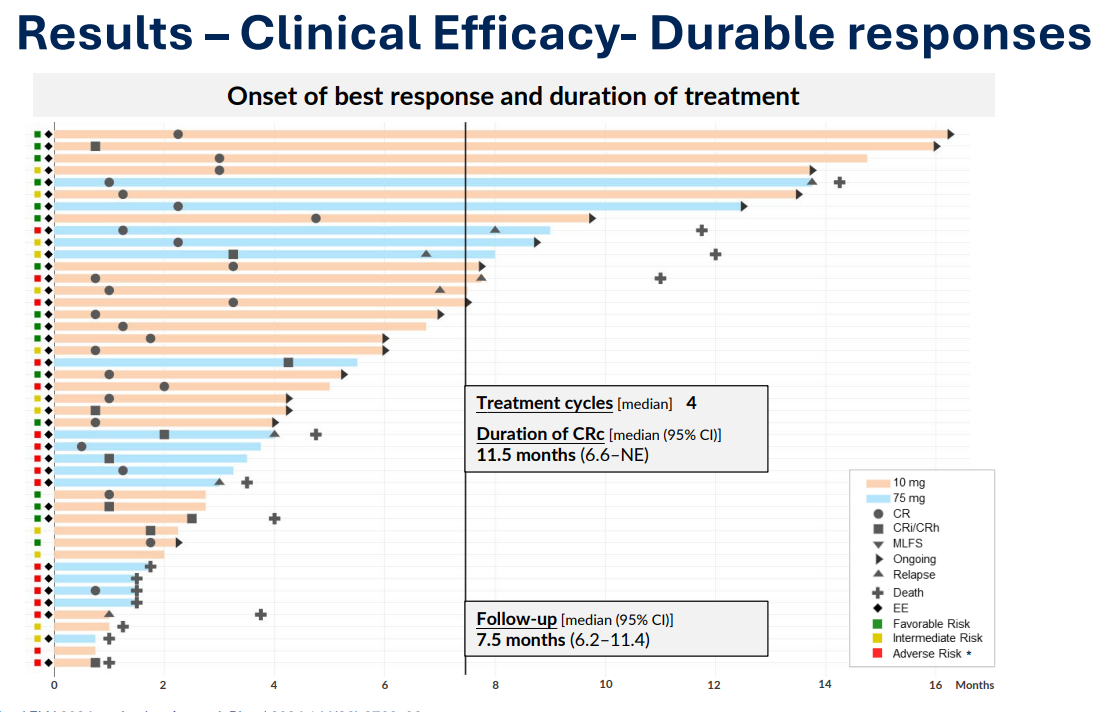
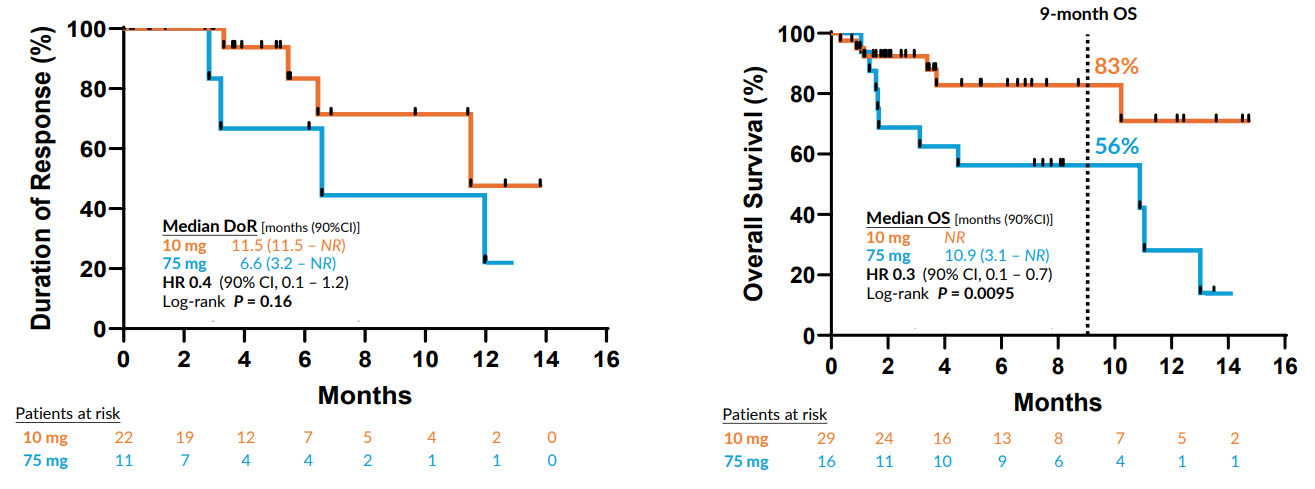
相关推荐

无癌生存3.5年!复合型免疫细胞疗法的临床捷报,抗癌战争进入多兵种协同作战的时代
在人类与癌症的漫长斗争中,治疗方法已经从粗略切除(手术)和盲目杀伤(放疗和化疗)发展到精确的靶向治疗。然而,癌症的狡猾和复杂性远远超出了人们的想象。单一的治疗方法在取得初步结果后往往面临耐药性和复发的困境。正是在这种情况下,免疫疗法应运而生。其中,复合免疫细胞疗法不再追求单一的“灵丹妙药”,而是致力于动员人体自身的防御...
免疫管家 2025-09-28