相关推荐

QT-019B的临床试验申请获得FDA批准
8月13日,启函生物宣布其自主研发的首款通用型双靶点CAR-T细胞产品QT-019B的新药临床试验申请已获得美国食品药品监督管理局(FDA)的正式批准。
免疫管家 2025-08-19

双靶向CD19/CD70同种异体CAR-T产品ALLO-329获得三项美国 FDA 快速通道资格
近日,Allogene Therapeutics宣布其在研双靶向 CD19/CD70 同种异体CAR-T产品ALLO-329已获得美国食品药物管理局(FDA)授予三项快速通道资格,用于治疗患有活动性难治性中度至重度系统性红斑狼疮(SLE)、活动性重度/难治性特发性炎症性肌病(IIM),特别是皮肌炎、免疫介导的坏死性肌病...
免疫管家 2025-04-08

英百瑞通用型NK细胞产品IBR900细胞注射液用于自身免疫性疾病的临床试验申请获受理
11月6日,国家药品监督管理局药品审评中心(CDE)显示:英百瑞递交的IBR900细胞注射液的临床试验申请获得受理,适应症为自身免疫性疾病(包括系统性红斑狼疮等)。
免疫管家 2024-11-08
CAR-T疗法引领重症肌无力、系统性红斑狼疮等自身免疫性疾病患者走向健康之路
8月12日,Kyverna宣布,美国食品药品监督管理局(FDA)指定其自体全人类CD19嵌合抗原受体(CAR)T细胞候选产品KYV-101为再生医学高级疗法(RMAT),用于治疗进行性重症肌无力患者。
免疫管家 2024-08-15

客观缓解达到惊人的100%!CAR-T疗法伊基奥仑赛惠及多发性骨髓瘤、自身免疫性疾病
7月24日,驯鹿生物宣布其自主研发的全人源靶向BCMA嵌合抗原受体自体T细胞注射液(伊基奥仑赛注射液)拟用于治疗多发性硬化症(Multiple Sclerosis, MS)的新药临床试验申请(IND)已获得美国食品药品监督管理局(FDA)的默示许可。
免疫管家 2024-07-25

UTAA09注射液治疗复发/难治性自身免疫性疾病的早期临床研究
UTAA09注射液是一款自主研制的现货通用型CD19-CAR-γδT细胞产品实现非基因编辑手段下的通用现货型治疗,降低生产成本与周期,避免患者自身免疫亢进的淋巴细胞污染。UTAA09注射液的临床前研究也充分体现了其优越的靶向清除能力及较好的安全性。
免疫管家 2024-07-19
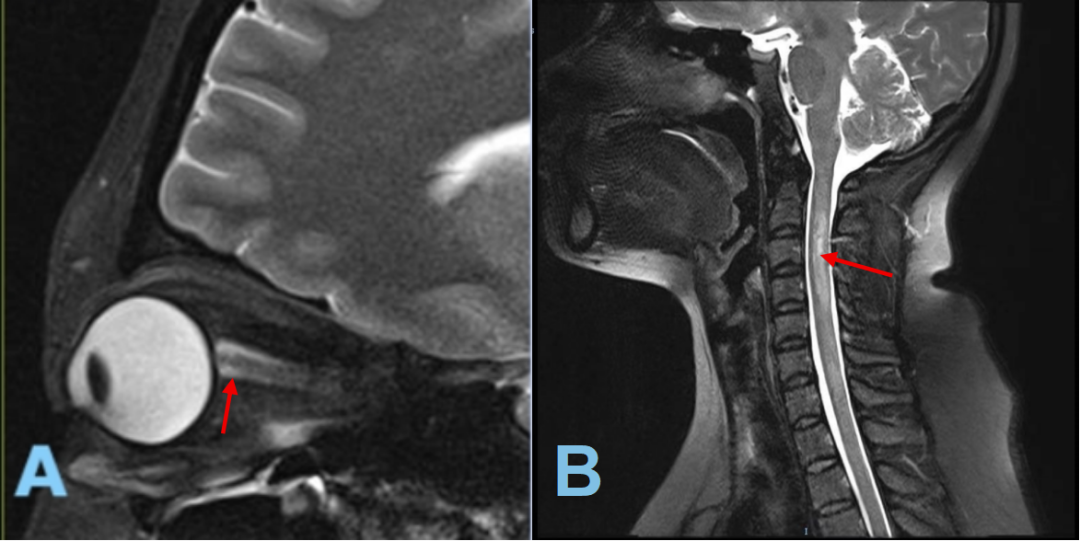
天津首例UCAR-T细胞疗法治疗视神经脊髓炎谱系疾病成功开展
近日,天津市某医院团队成功开展了天津首例UCAR-T细胞疗法治疗视神经脊髓炎谱系疾病(NMOSD),患者已顺利出院。
免疫管家 2025-07-28