相关推荐
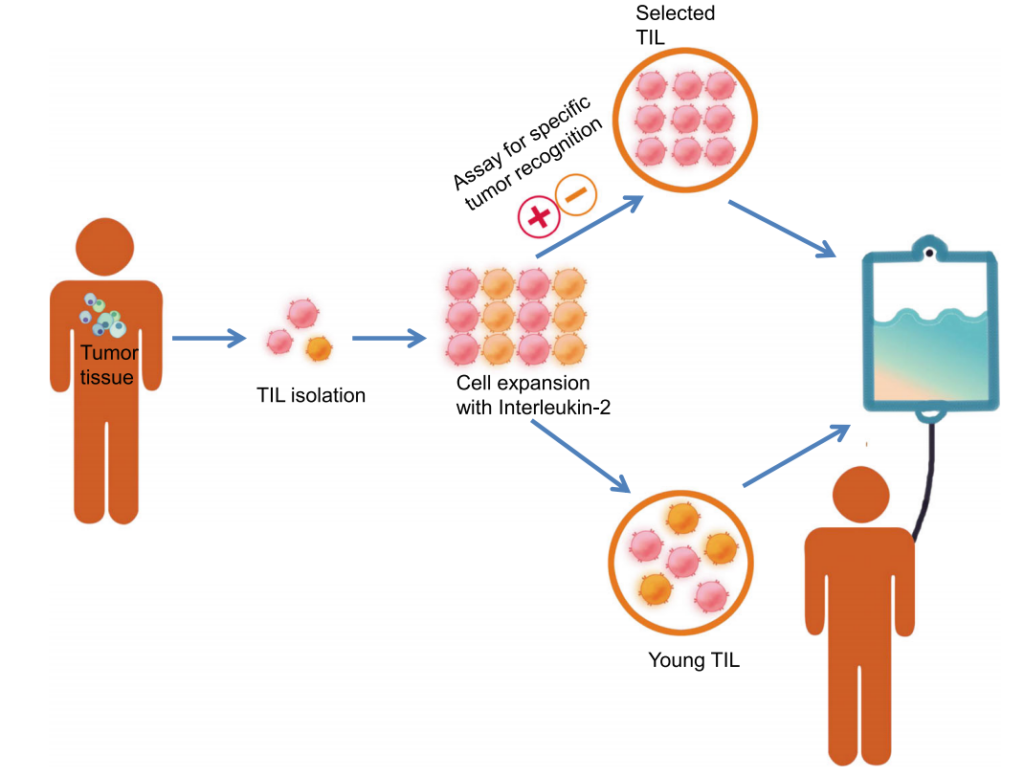
生存超10年!TIL疗法点燃黑色素瘤、宫颈癌、肝癌等实体瘤治疗新希望,中位缓解超3年
在人类与癌症的漫长斗争中,治疗手段已经逐渐从粗暴切除发展到精准的靶向治疗。而近年来,免疫疗法的兴起,特别是过继性细胞疗法,给我们带来了新的希望。其中,肿瘤浸润淋巴细胞(TIL)治疗以其独特的优势成为实体瘤治疗领域的一颗新星。
免疫管家 2025-09-25

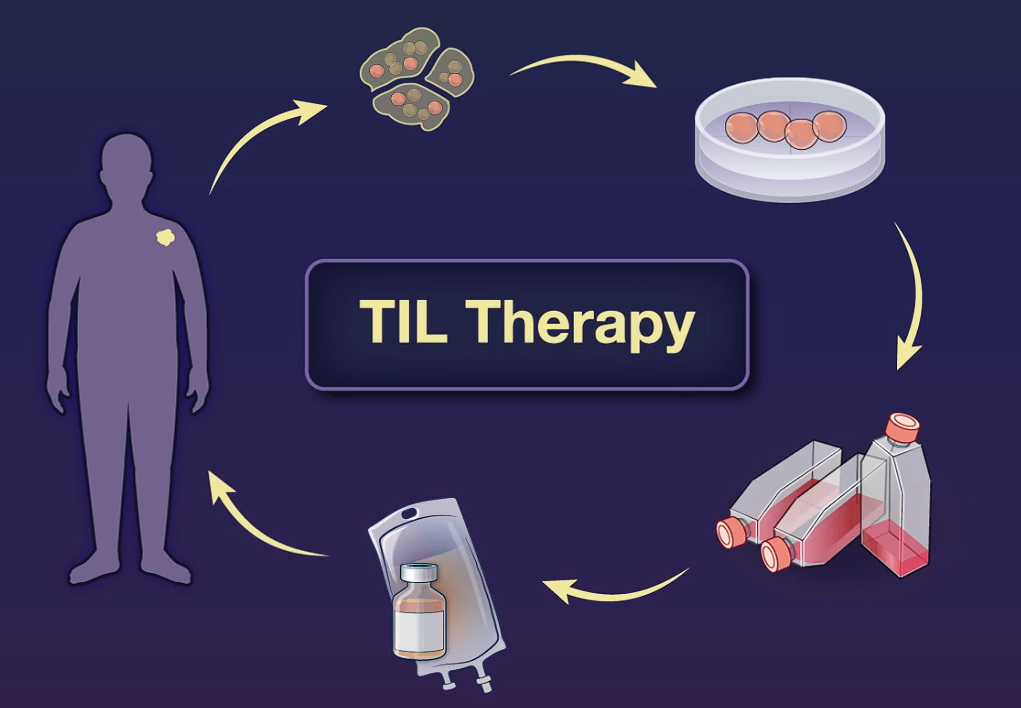
无癌超4年!TIL细胞疗法创造生命奇迹,黑色素瘤、子宫内膜癌、头颈癌、宫颈癌等患者获益
在过去的几年中,细胞免疫疗法为癌症治疗提供了一种新的策略。最近的临床研究表明,肿瘤浸润淋巴细胞(TIL)治疗在晚期实体瘤的治疗中显示出良好的疗效,这为癌症患者带来了新的希望。
免疫管家 2025-09-18

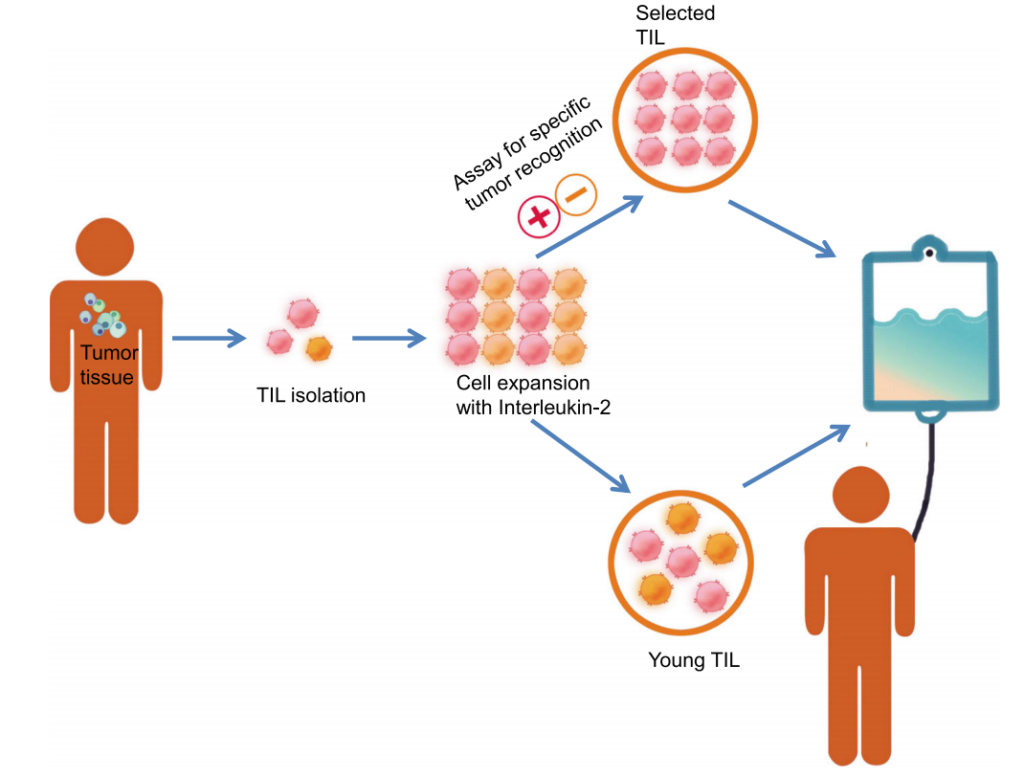
肿瘤减少57.1%!TIL疗法惠及黑色素瘤、宫颈癌、肺癌、肝癌、乳腺癌……疾病控制率高达90%
随着技术水平不断提升,人们对癌症的探索逐渐深入,癌症治疗的策略也在不断改变。而近年来,利用免疫系统来对抗癌细胞被发现是一种非常具有潜力的治疗方式。其中肿瘤浸润淋巴细胞(TIL)疗法已成为一种有前途的实体瘤治疗策略,并在2024年被批准用于既往接受过免疫检查点抑制剂和BRAF/MEK靶向治疗(如适用)的晚期黑色素瘤患者。
免疫管家 2025-08-28

2025 ASCO年会重磅预告:TIL疗法全球数据井喷,宫颈癌、肝癌、肺癌、头颈癌、黑色素瘤等癌种全覆盖
肿瘤浸润淋巴细胞(TIL)细胞疗法作为细胞治疗的一种,正逐渐崭露头角。随着2025年美国临床肿瘤学会(ASCO)年会的临近,多种基于TIL的疗法将成为焦点,展示其在癌症治疗中的巨大潜力。
免疫管家 2025-05-29

靶病灶完全消退!TIL细胞疗法在肝癌、黑色素瘤、头颈癌、宫颈癌、卵巢癌、肺癌领域屡创奇迹
近日,百吉生物宣布其研发的全球首款针对肝癌的肿瘤浸润淋巴细胞(TIL)产品-BST02注射液的一期临床试验中取得了显著进展。其中一名患者靶病灶完全消退。
免疫管家 2025-03-21

惊!TIL细胞疗法让肿瘤“大缩水” ,卵巢癌、肺癌、黑色素瘤、宫颈癌、鼻咽癌中显威
TIL细胞疗法作为一种新兴的个体化免疫治疗技术,从患者肿瘤中提取一组TIL并优化扩增TILs细胞数量,为患者提供一支数量庞大的免疫细胞大军,通过输注TIL,使TIL直接进入肿瘤开始工作,可以更加有效提高TILs细胞的杀伤力。近年来,TIL疗法在国内外受到广泛关注,国内已启动多项TIL疗法的临床试验,覆盖黑色素瘤、宫颈癌...
免疫管家 2025-03-10

爆款“抗癌神药”TIL细胞疗法,Celine Ryan靠它击退癌症,国内肺癌、卵巢癌、宫颈癌等患者的希望
1979年美国国家癌症研究所(NCI)的Rosenberg教授发现肿瘤组织细胞在IL-2环境中培养时,其中的淋巴细胞会在增殖的同时杀死癌细胞,并在之后证明TIL有效性。
免疫管家 2025-02-17

“取之于瘤,用之于瘤”的TIL细胞疗法横扫黑色素瘤、肺癌、宫颈癌、肝癌、结直肠癌等
肿瘤浸润淋巴细胞(TIL)是存在于肿瘤内部的“奸细”,通过释放细胞毒素来直接杀伤癌细胞。为了加强TILs细胞的杀伤能力,研究人员对TILs细胞进行优化扩增,从而提高TILs细胞的数量以及质量,来有效提高战力,以此来有效杀伤癌细胞。自美国癌症研究员的Steven Rosenberg主任对TIL细胞进行研究改进并用于用于癌...
免疫管家 2025-01-13

预计有两款TIL细胞产品将要上市!肺癌、卵巢癌、宫颈癌、肝癌等实体瘤患者希望之光
12月18日,全球设计产能最大的TIL细胞产业化基地落户上海,将为患者提供安全、高效、惠民的TIL细胞新药。而据报道,TIL细胞产品GC101预计将于2026年上市;全球首创的非病毒载体基因修饰TIL GC203预计将于2027年上市。
免疫管家 2024-12-20
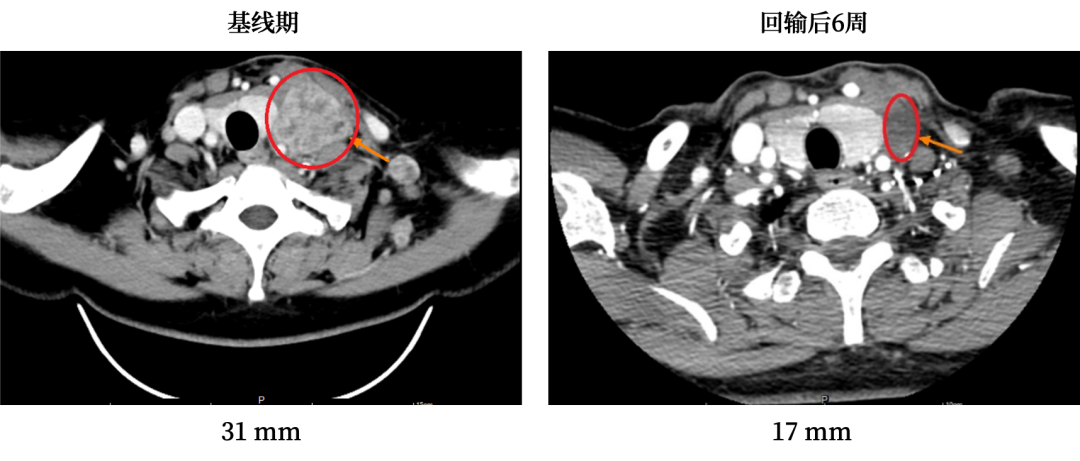
癌症克星登场!TIL细胞疗法惠及肺癌、宫颈癌、黑色素瘤……持续缓解超三年
TIL细胞疗法通过将存在于肿瘤组织内部的肿瘤浸润淋巴细胞优化扩增后,让这些细胞拥有更加强大的识别和杀伤肿瘤的能力,然后将这些细胞回输至患者体内,让这些升级加强后的肿瘤浸润淋巴细胞对抗肿瘤。
免疫管家 2024-12-10