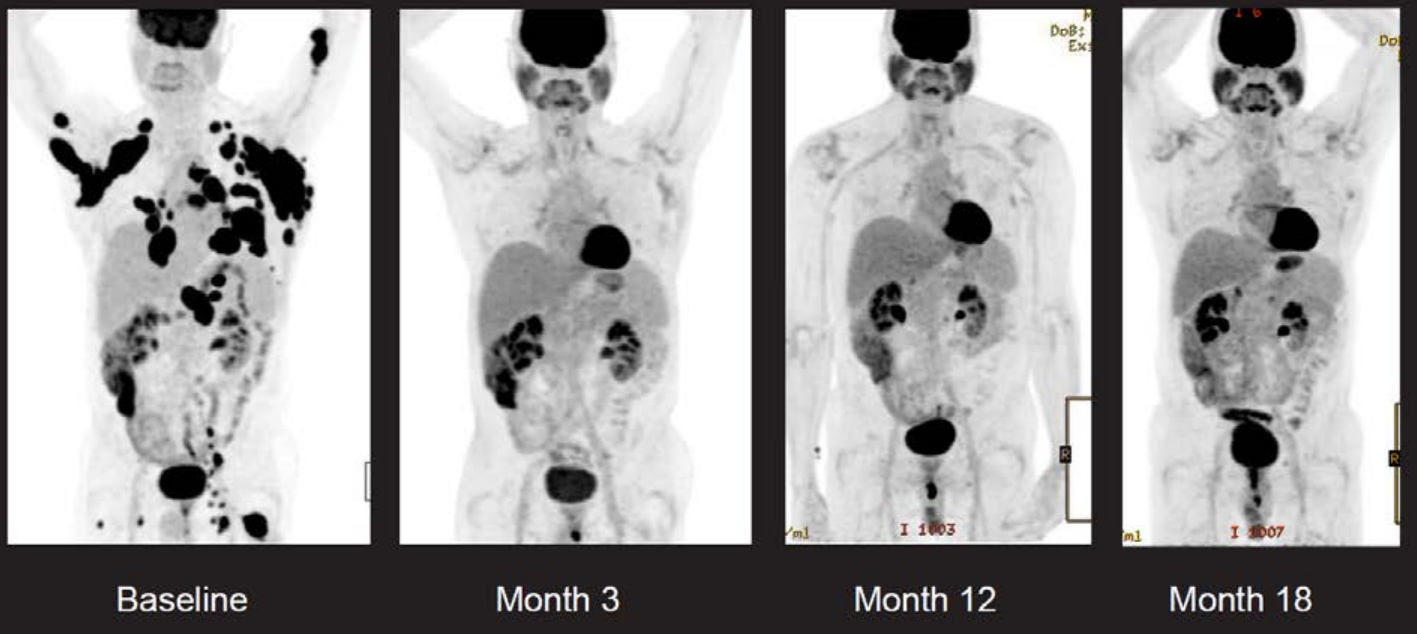
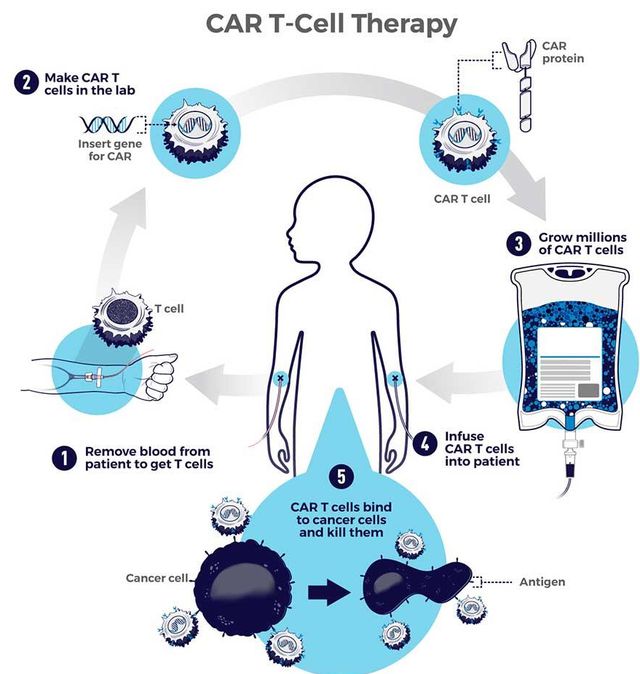
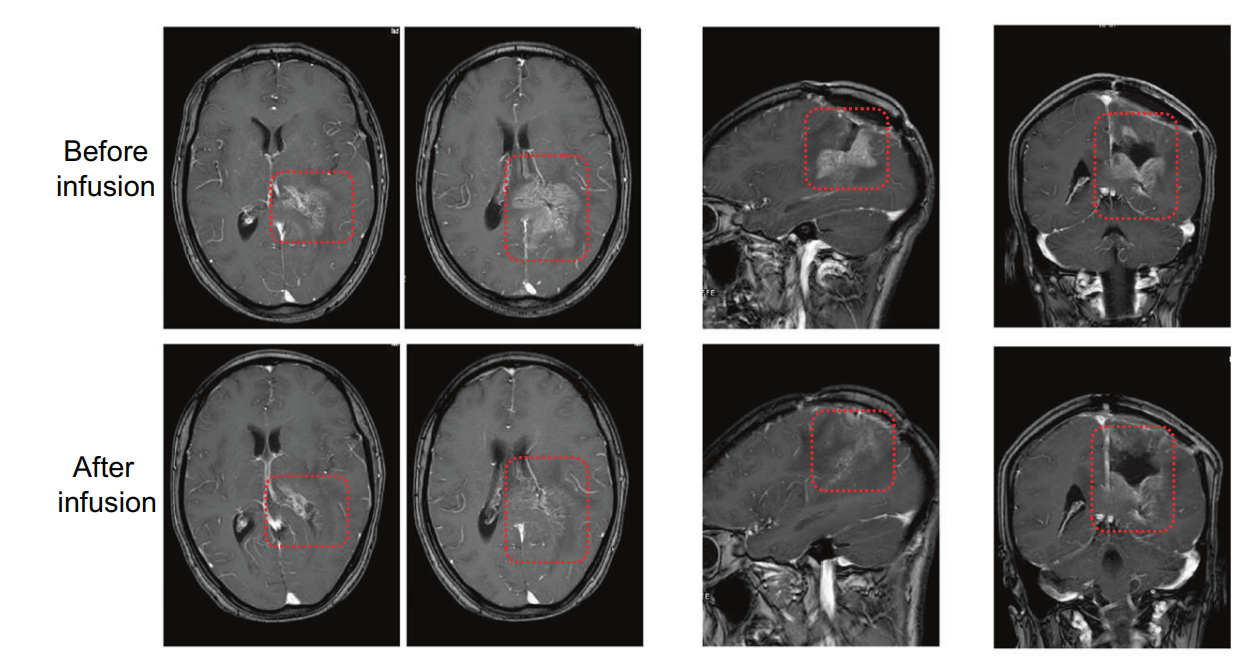
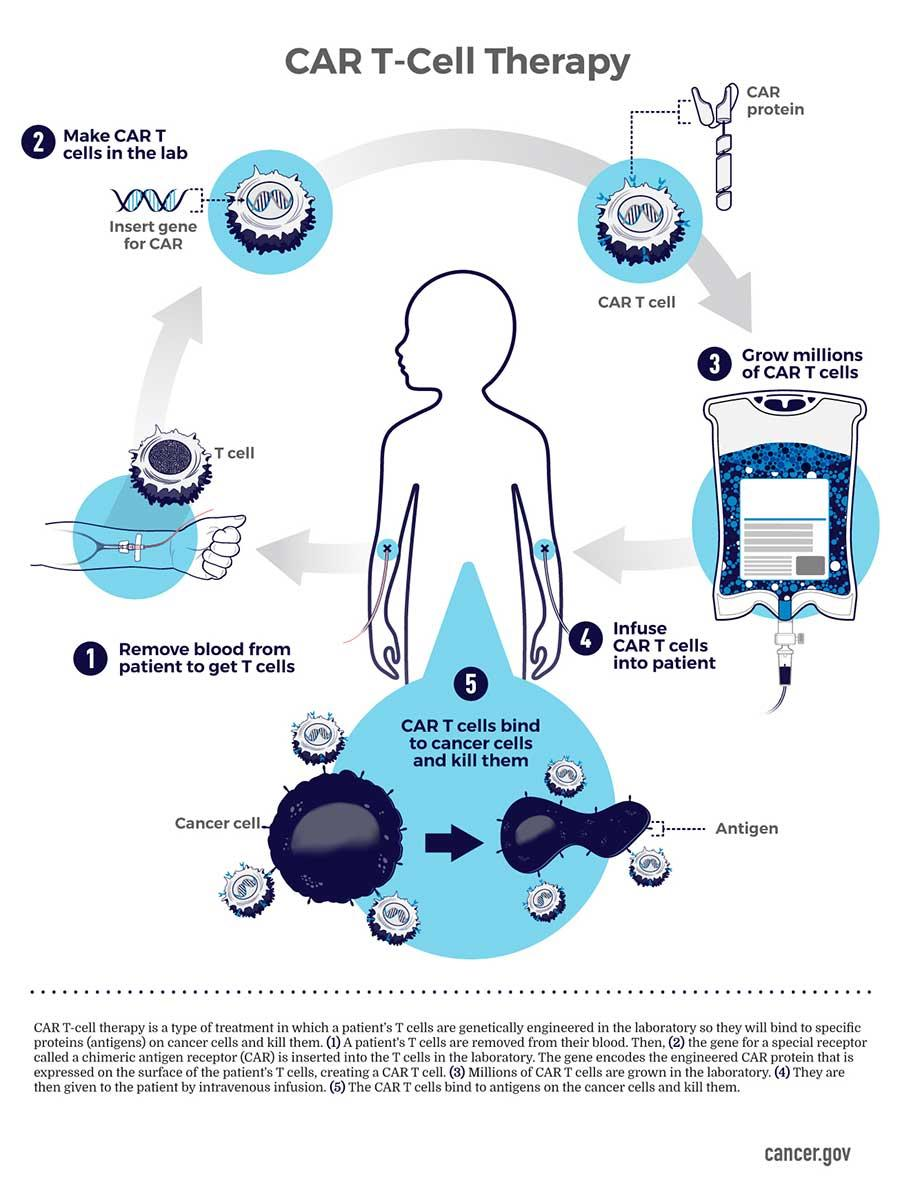
热门推荐
- 精 缓解超2年!CAR-T疗法横扫多发性骨髓瘤、B细胞淋巴瘤,缓解率实现惊人的100%!
- 精 实至名归!CAR-T先驱获2024年沃伦·阿尔珀特奖!CAR-T细胞疗法重击淋巴细胞白血病!
- 精 靶向GPC3的CAR-T疗法联合药物获得了完全缓解和长期生存,肝细胞癌患者的福音
- 精 CAR-T细胞产品-CT071获批,血液系统肿瘤患者又增新的治疗选择
- 精 GRP78 CAR-T的研究让肿瘤治疗更上一层楼
- 精 CAR-T产品-纳基奥仑赛价格跌破百万,肿瘤患者的福音
- 精 PD-1免疫抑制剂与CAR-T细胞疗法让肿瘤无处躲藏
- 精 CAR-T细胞疗法在骨髓瘤,白血病以及淋巴瘤中大展身手!
- 精 CAR-T在多种实体瘤和血液瘤中全面开花!
- 精 与时间赛跑,CAR-T疗法让淋巴瘤患者重获新生!
- 精 攻克癌症有方法——CAR-T,TILS各显神通
- 精 白血病并不是不治之症CAR-T细胞疗法在血液肿瘤大放光彩
- 精 “抗癌神药”CAR-T疗法到底是班门弄斧还是真有奇效?免疫管家与你揭开谜底。
- 精 解密CAR-T疗法真实治疗流程,细胞治疗到底需要多久呢?
- 精 CAR-T疗法再传捷报!卵巢癌,结肠癌再创佳绩!攻克实体瘤火力全开!!
- 精 120万一支,天价抗癌药,到底值不值?
资讯列表
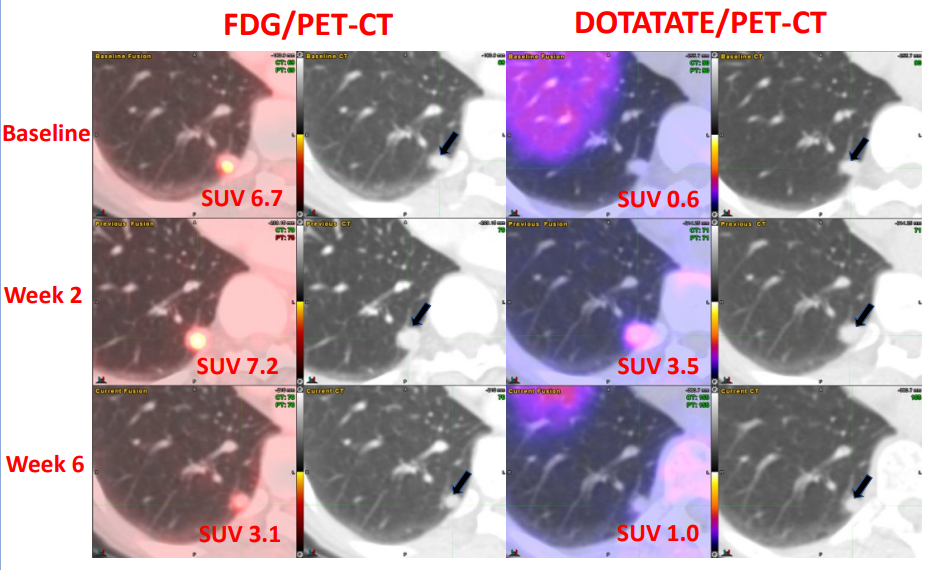
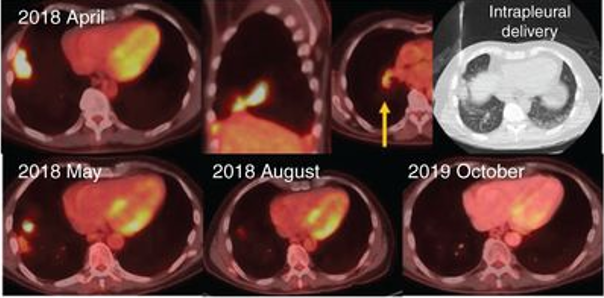
2024年7月23日,AffyImmune宣布美国食品和药物管理局(FDA)授予CAR - T细胞候选产品AIC100为再生医学高级疗法(RMAT),作为复发性间变性甲状腺癌(ATC)患者的潜在治疗方法。
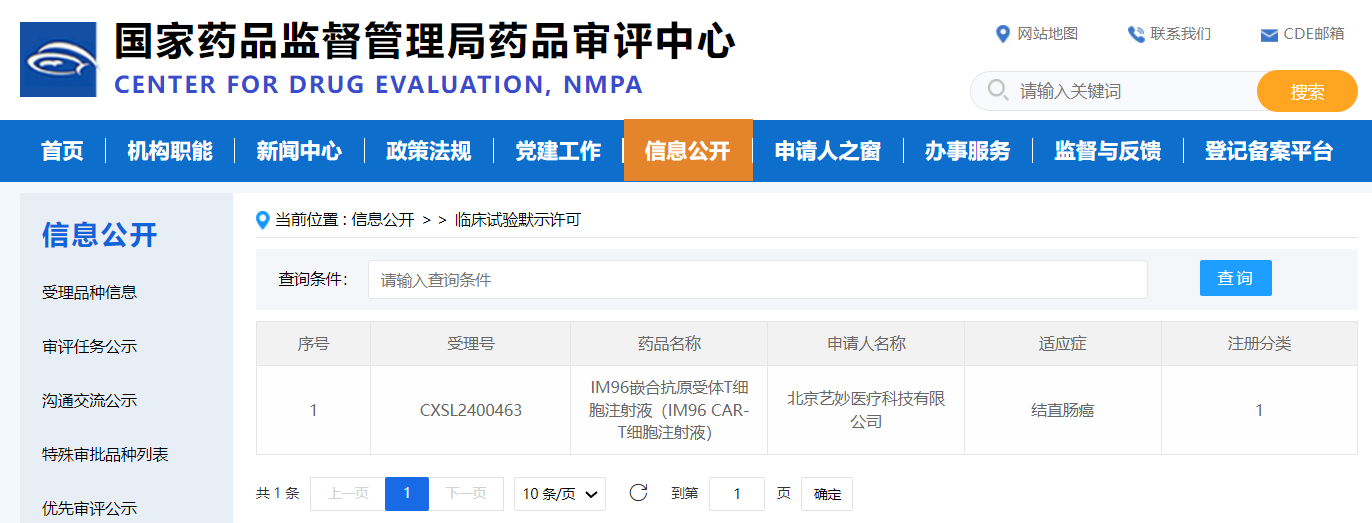
2024年10月12日,据国家药品监督管理局药品审评中心(CDE)官网显示,艺妙神州与北京大学肿瘤医院合作开发的用于治疗转移性结直肠癌的全新一代抗肿瘤药物IM96嵌合抗原受体T细胞注射液(IM96 CAR-T细胞注射液,简称“IM96”)获得国家药品监督管理局药品审评中心(CDE)临床试验默示许可。
10月8日,Aurigene Oncology宣布靶向BCMA的CAR-T细胞疗法Ribrecabtagene autoleucel (DRL-1801)用于复发/难治性多发性骨髓瘤患者的I期临床试验结果。
10月8日,Aurigene Oncology宣布靶向BCMA的CAR-T细胞疗法Ribrecabtagene autoleucel (DRL-1801)用于复发/难治性多发性骨髓瘤患者的I期临床试验结果。
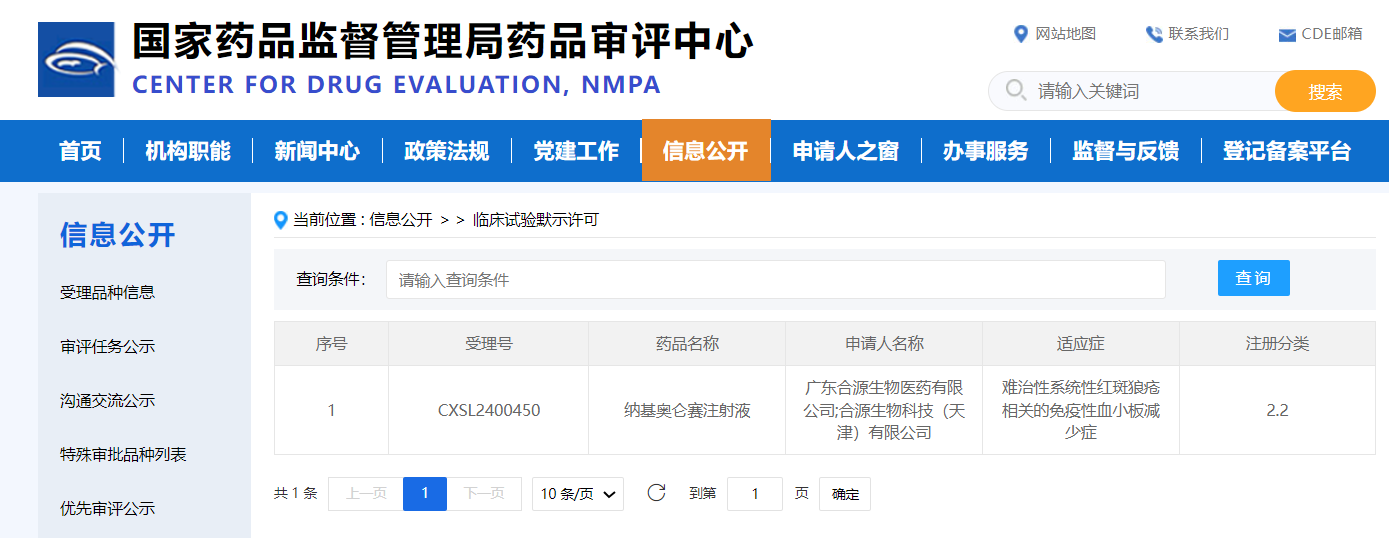
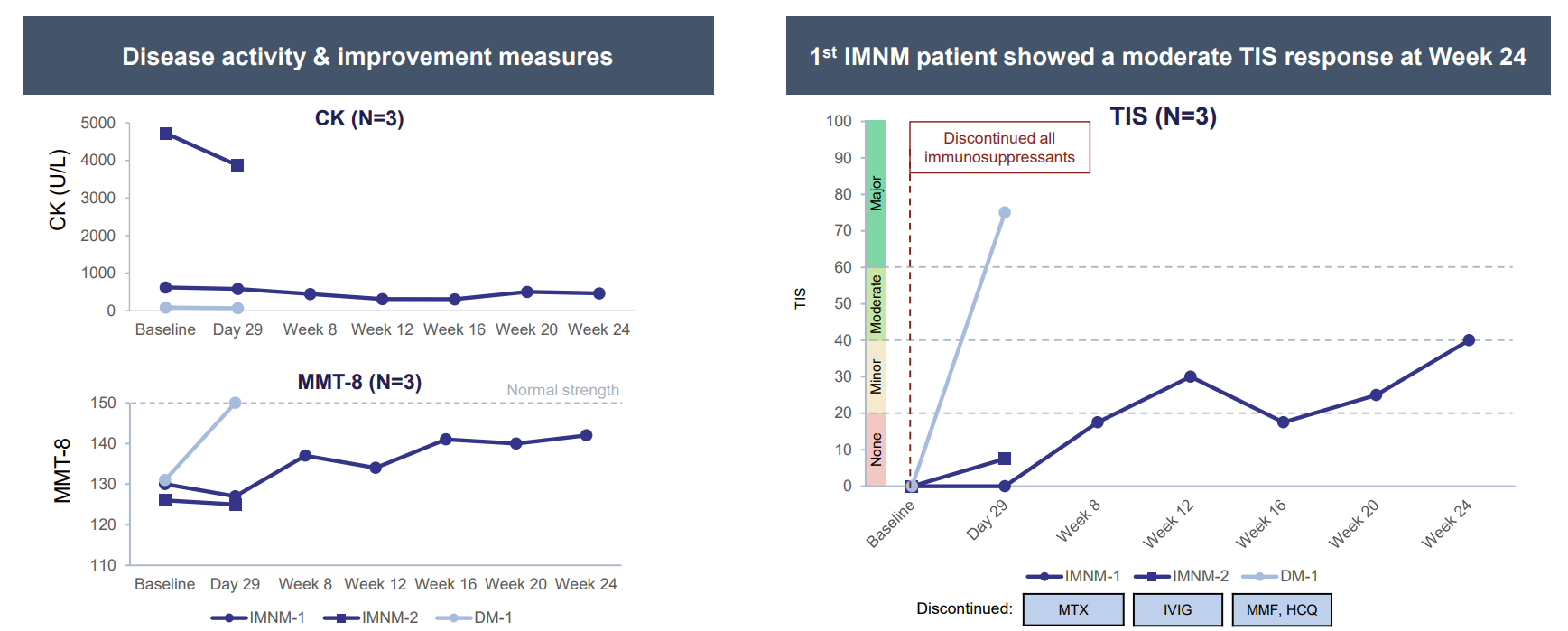
10月11日,国家药品监督管理局药品审评中心(CDE)显示:CAR-T细胞治疗产品源瑞达(纳基奥仑赛注射液)新药临床试验申请(IND)获得默示许可,用于治疗难治性系统性红斑狼疮相关的免疫性血小板减少症(SLE-ITP)。
10月11日,国家药品监督管理局(NMPA)药品审评中心(CDE)网站公示信息显示:合源生物首款原研CAR-T细胞治疗产品源瑞达®(纳基奥仑赛注射液)的自身免疫性疾病领域新增适应症新药临床试验申请(IND)获得默示许可,用于治疗难治性系统性红斑狼疮相关的免疫性血小板减少症(SLE-ITP)。
10月12日,易慕峰生物宣布其靶向CLDN18.2的自体CAR-T产品IMC002获得美国食品和药品管理局(FDA)孤儿药资格认定(ODD),用于治疗胰腺癌患者。此次孤儿药资格认定的获得不仅凸显了IMC002在胰腺癌治疗领域的显著潜力,而且为患者带来了新的治疗希望。
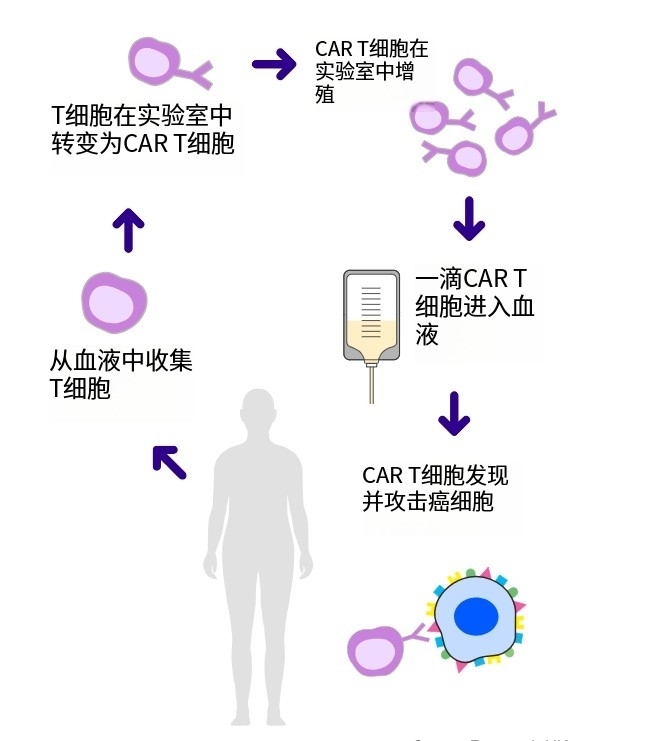
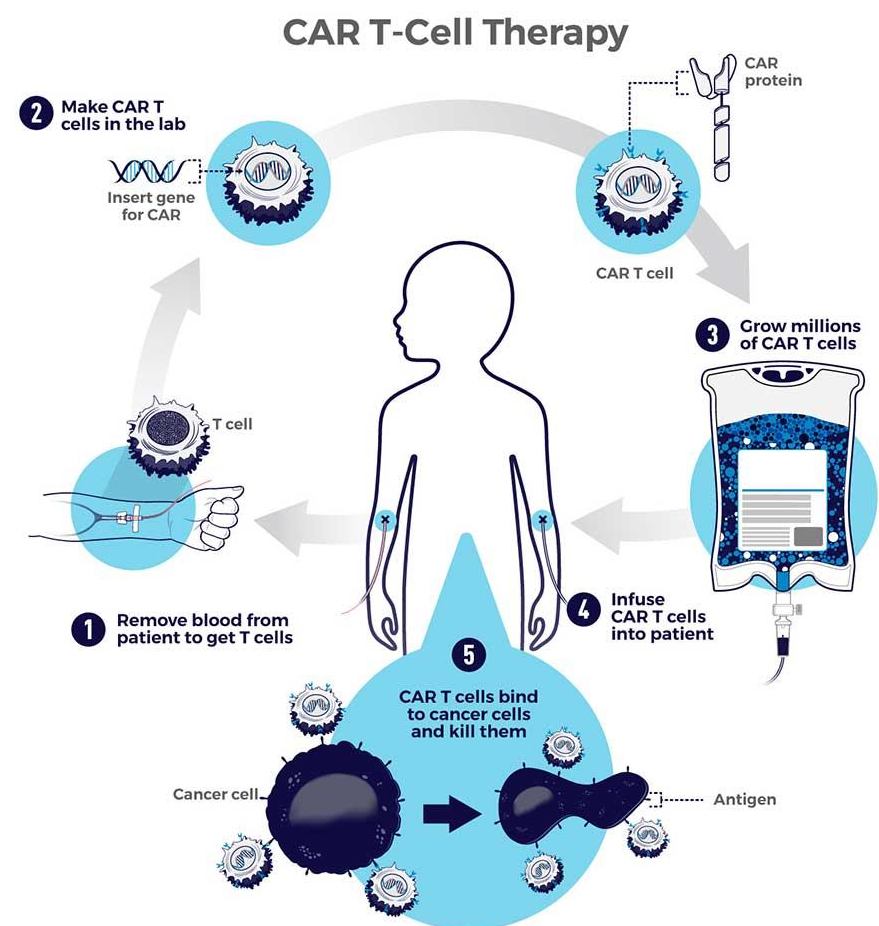
嵌合抗原受体(CAR)T细胞疗法是血液系统肿瘤的“救星”,通过给T细胞安装“GPS”来精准杀伤癌细胞,目前正在实体瘤中进行研究。