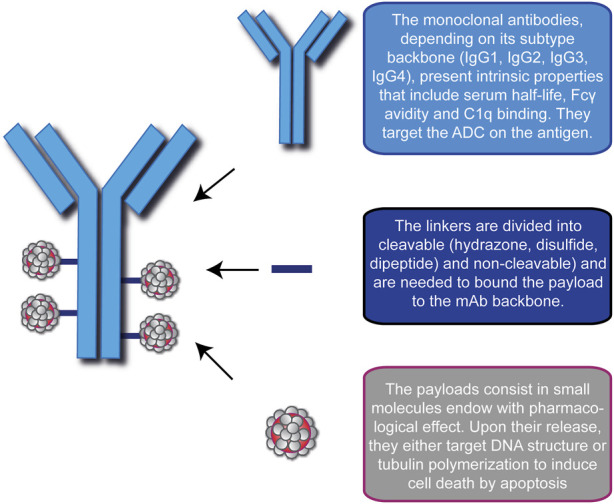
热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
TCR-T是什么细胞TCR-T疗法也是过继细胞转移疗法(ACT)的一种,通过筛选和鉴定能特异性结合靶抗原的TCR序列,利用基因工程改造来自患者外周血的T细胞,然后将改造后的T细胞回输至患者体内,使其能特异性识别并杀伤表达抗原的肿瘤细胞,从而达到治疗肿瘤的目的。是近年来癌症治疗新方法的焦点,这种新型的免疫基因疗法,可以让...
2月19日,美国食品药品监督管理局(FDA)批准acalabrutinib(Calquence)联合Venclexta于治疗成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者。
2月13日,国家药品监督管理局药品审评中心(CDE)显示:MK-1084片拟纳入突破性治疗,联合帕博利珠单抗用于一线治疗PD-L1 TPS ≥50%且有KRAS G12C突变的NSCLC患者。
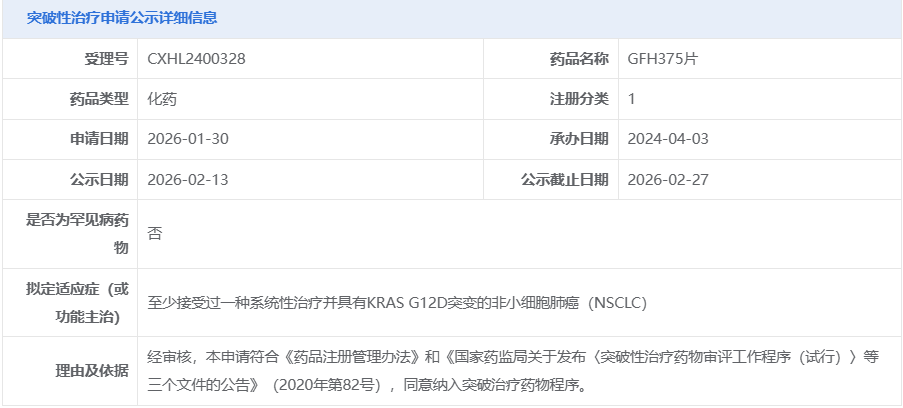
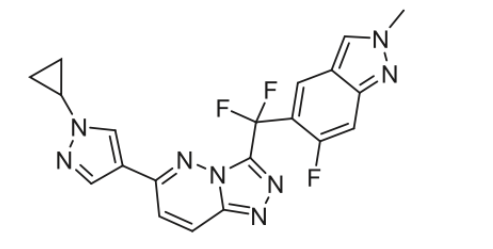
2月13日,国家药品监督管理局药品审评中心(CDE)显示:GFH375片拟纳入突破性治疗,用于至少接受过一种系统性治疗并具有KRAS G12D突变的非小细胞肺癌(NSCLC)。
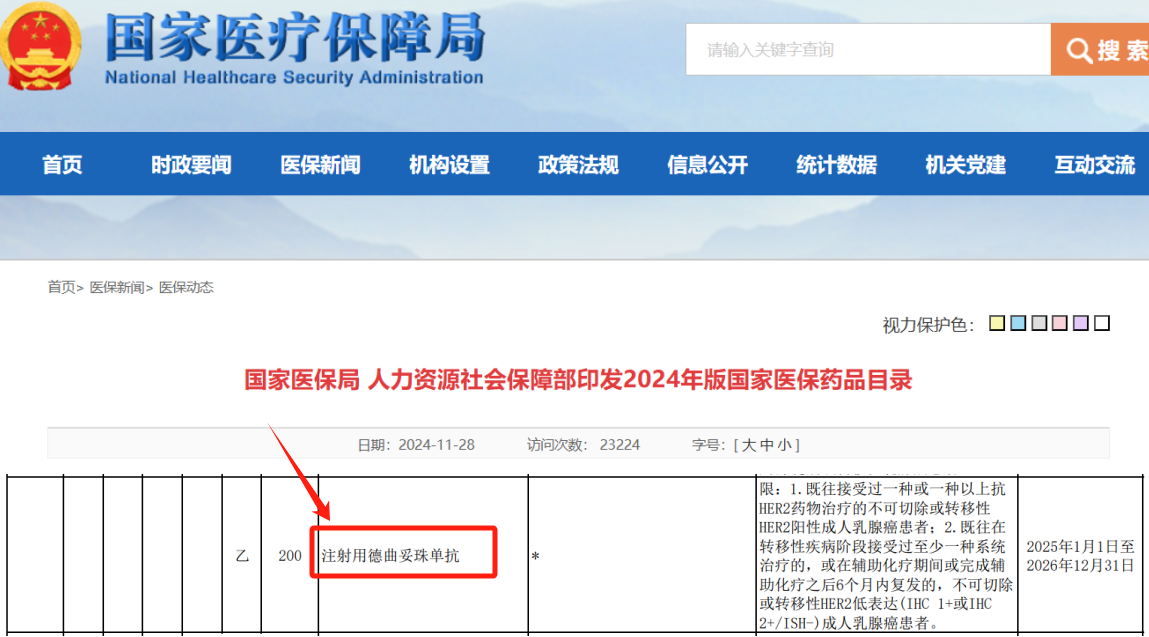
2月12日,第一三共宣布注射用德曲妥珠单抗上市申请已成功提交国家药品监督管理局,拟用于接受抗HER2新辅助治疗后仍残存侵袭性病灶的HER2阳性成人乳腺癌患者的治疗。这是注射用德曲妥珠单抗在中国提交的第九个适应症的上市申请,也是其在中国申报的第六个乳腺癌适应症的上市申请。
2月4日,《nature medicine》发表了瑞普替尼(Repotrectinib)用于NTRK融合阳性晚期实体肿瘤患者的1/2期TRIDENT-1临床试验结果。
2月9日,国家药品监督管理局药品审评中心(CDE)显示:注射用QLC5508拟纳入突破性治疗,用于雄激素受体(AR)通路抑制剂和紫杉类化疗治疗失败的转移性去势抵抗性前列腺癌(mCRPC)成人患者。
2月9日,国家药品监督管理局药品审评中心(CDE)显示:注射用QLC5508拟纳入突破性治疗,用于既往一线接受含铂化疗和免疫检查点抑制剂(ICI)治疗后失败的不可切除的局部晚期或转移性食管鳞癌患者的治疗。