热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
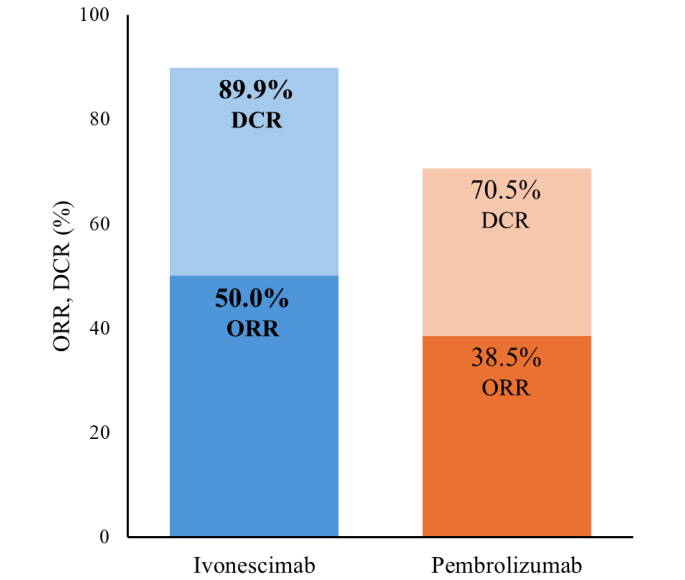
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
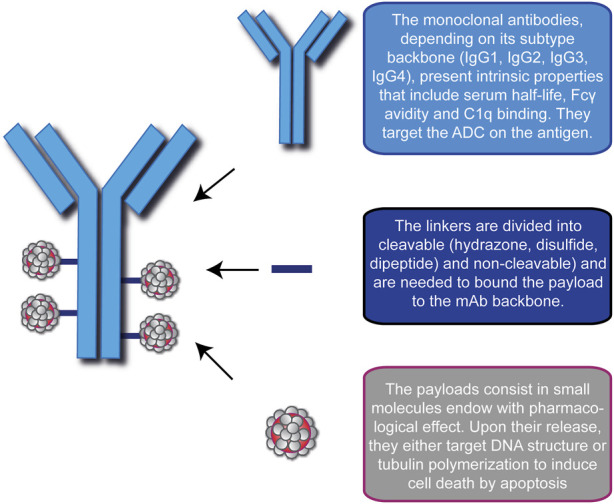
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
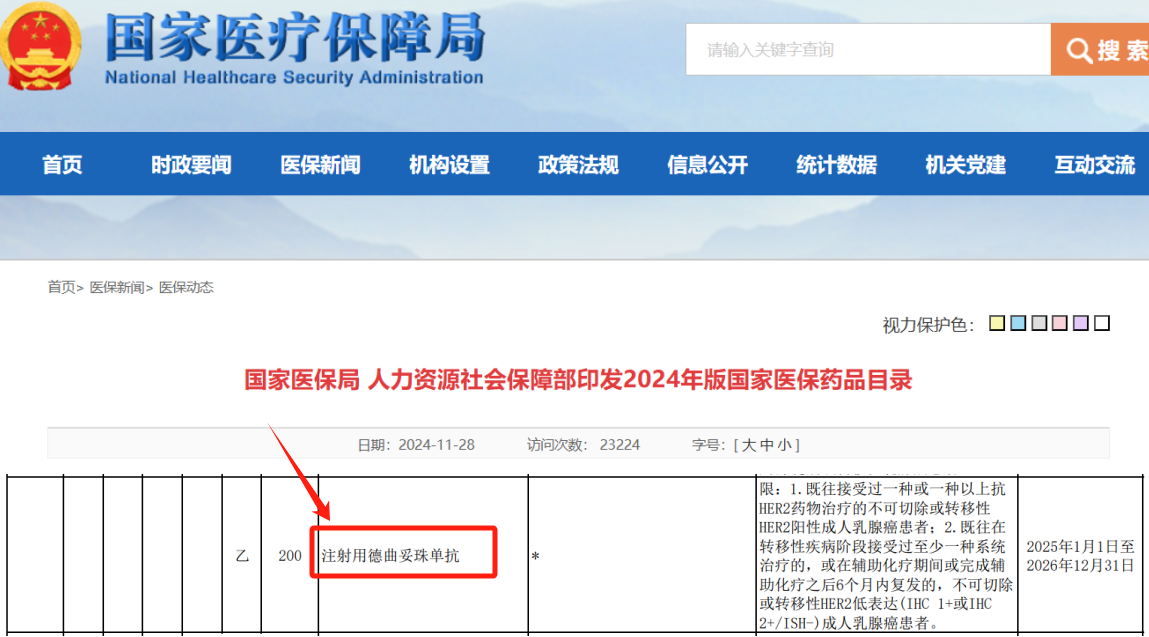
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
2024世界肺癌大会(WCLC)将在美国圣迭戈召开,此次会议中,卡瑞利珠单抗联合化疗后同步放化疗治疗局限期小细胞肺癌(LD-SCLC)的II期研究的初步结果数据即将公布。
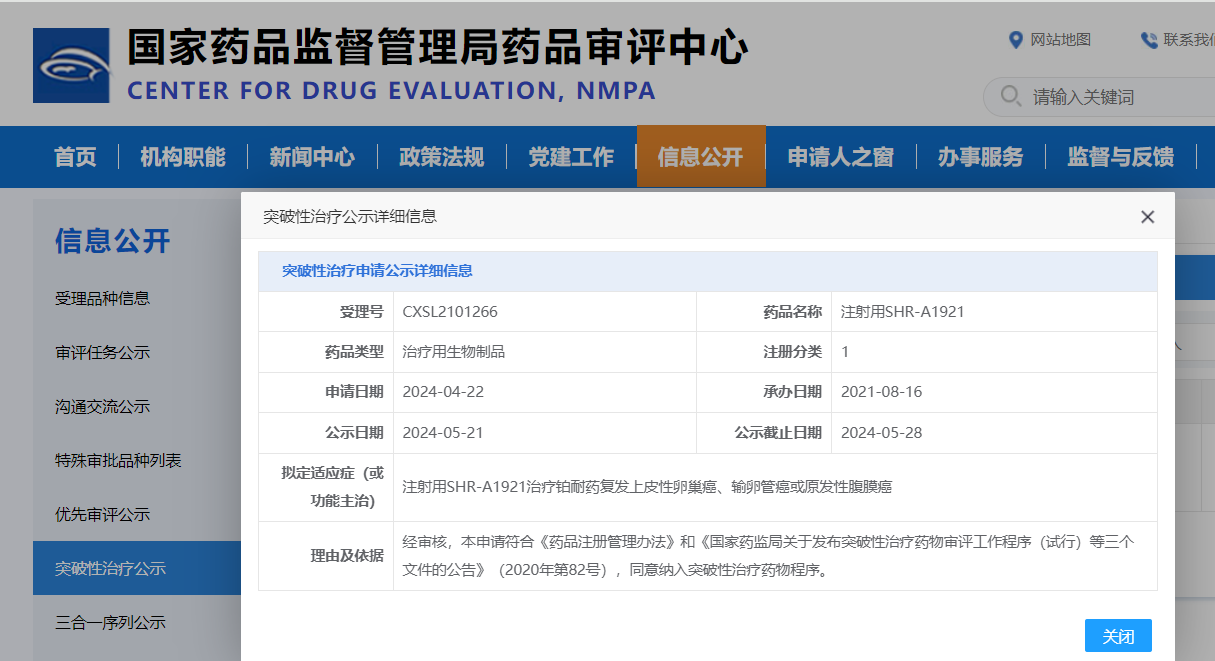
2024世界肺癌大会(WCLC)将在美国圣迭戈召开,此次会议中,TROP-2靶向抗体药物偶联物(ADC)SHR-A1921用于晚期小细胞肺癌(SCLC)的1期研究(NCT05154604)数据即将公布。
8月27日,百济神州宣布美国食品药品监督管理局(FDA)授予靶向BTK的在研嵌合式降解激活化合物(CDAC)BGB-16673快速通道认定,用于治疗既往接受过至少两线治疗(包括BTK抑制剂和BCL2抑制剂)的R/R CLL/SLL成年患者。
8月21日,《新英格兰医学杂志》发表了一篇题为“Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma”的研究论文,文中介绍了Belzutifan(贝组替凡)治疗肾细胞癌的III期LITESPARK-005试验结果。
8月21日,《新英格兰医学杂志》发表了一篇题为“Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma”的研究论文,文中介绍了Belzutifan(贝组替凡,Welireg,)治疗肾细胞癌的III期LITESPARK-005试验结果。
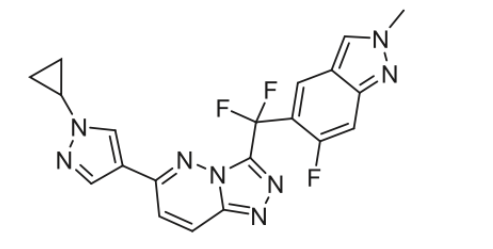
8月21日,国家药品监督管理局(NMPA)批准KRAS G12C抑制剂氟泽雷塞片(达伯特,IBI351)上市用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。值得注意的是,这是国内首个获批的KRAS G12C抑制剂。
8月21日, 国家药品监督管理局(NMPA)批准KRAS G12C抑制剂氟泽雷塞片(商品名:达伯特)上市用于治疗至少接受过一种系统性治疗的鼠类肉瘤病毒癌基因(KRAS)G12C突变型的晚期非小细胞肺癌(NSCLC)成人患者。值得注意的是,这是中国首个获批的KRAS G12C抑制剂。